Ответы ко второй части варианта №25
Задание 30
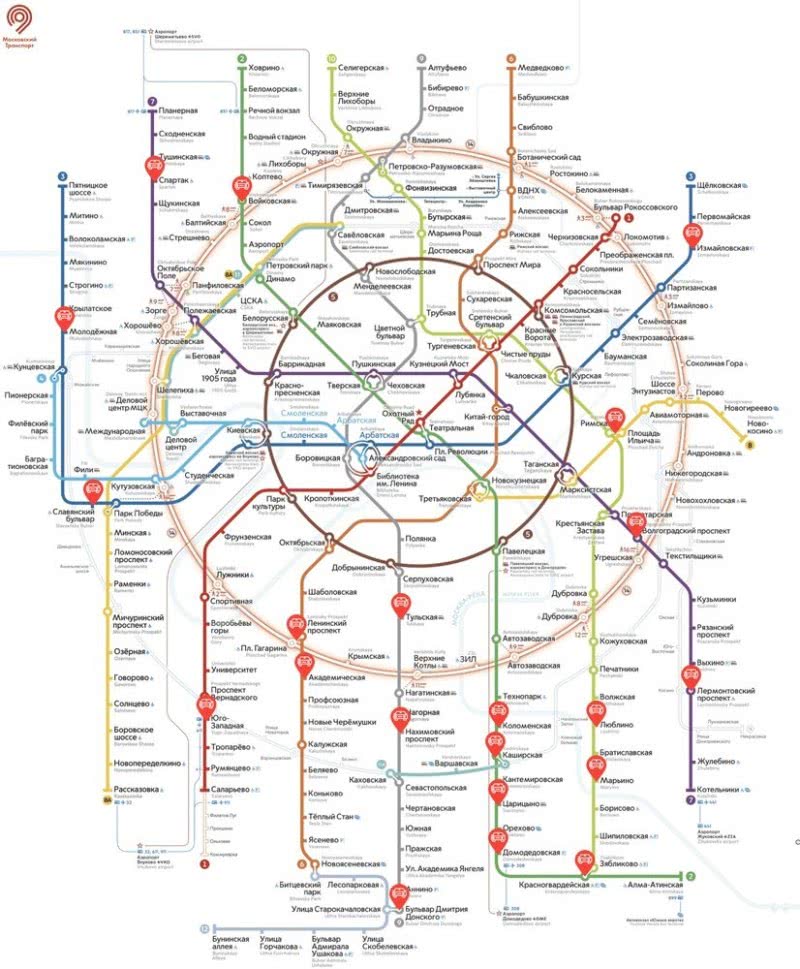
Zn(ClO3)2 + 12HCl = ZnCl2 + 6Cl2 + 6H2O
5∙ | 2Cl-1 − 2ē → Cl2
1∙ | 2Cl+5 + 10ē → Cl2
хлор в степени окисления -1 (или хлороводород) является восстановителем;
хлор в степени окисления +5 (или хлорат цинка) – окислителем.
Задание 31
Al2(SO4)3 + 3Na2SO3 + 3H2O = 2Al(OH)3 + 3Na2SO4 + 3SO2
2Al3+ + 3SO42- + 6Na+ + 3SO32- + 3H2O = 2Al(OH)3 + 6Na+ + 3SO42- +3SO2
2Al3+ + 3SO32- + 3H2O = 2Al(OH)3 + 3SO2
Задание 32
1) 4Cr(NO3)3 = 2Cr2O3 + 12NO2 + 3O2
2) 4Cu + 2NO2 = 4CuO + N2
3) 2CuO + 4NaI + 2H2SO4 = 2CuI + I2 + 2Na2SO4 + 2H2O
4) I2 + KHS = KI + HI + S
Задание 34
Навеску смеси ацетата серебра и ацетата меди (II) растворили в воде. Полученный раствор массой 88 г подвергли электролизу с инертными электродами и остановили процесс в момент, когда на катоде начал выделяться газ. Масса раствора при этом уменьшилась на 10%. Определите массовую долю ацетата серебра в исходной навеске, если известно, что для поглощения одного из газообразных продуктов электролиза необходимо минимум 89,6 г 5%-ного раствора гидроксида калия. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение:
Запишем уравнения происходящих реакций:
2CH3COOAg = 2Ag + 2CO2 + C2H6 (I)
Cu(CH3COO)2 = Cu + 2CO2 + C2H6 (II)
KOH + CO2 = KHCO3 (III)
Вычислим массу и количество щелочи:
m(KOH) = m(p-pa KOH) · ω(KOH)/100% = 89,6 г · 5%/100% = 4,48 г;
ν(KOH) = m(KOH)/M(KOH) = 4,48 г/56 г/моль = 0,08 моль.
Далее определим количество углекислого газа:
ν(CO2) = ν(KOH) = 0,08 моль.
Рассмотрим данные об изменении массы раствора. Процесс электролиза остановили в момент, когда на катоде начал выделяться газ. Это означает, что электролиз воды в процессе не происходил, а соли израсходовались до конца. Поскольку в ходе электролиза соли полностью переходят в газ и осадок, изменение массы раствора по значению равно сумме масс исходных солей. Вычислим их массу:
Δm = m(p-pa)·10%/100% = 88г · 10%/100% = 8,8 г;
m(CH3COOAg + Cu(CH3COO)2) = Δm = 8,8 г.
Пусть в исходной смеси было х моль ацетата серебра и у моль ацетата меди (II) по массе 167х г и 182у г соответственно. Тогда при их электролизе получилось (х + 2у) моль углекислого газа. Составим и решим систему уравнений:
х + 2у = 0,08
167х + 182у = 8,8
х = 0,08 — 2у
167(0,08 — 2у) + 182у = 8,8
х = 0,08 — 2у
13,36 — 334у + 182у = 8,8
х = 0,08 — 2у
4,56 = 152у
у = 0,03
х = 0,02
ν(CH3COOAg) = 0,02 моль;
ν(Cu(CH3COO)2) = 0,03 моль.
Найдем массу ацетата серебра:
m(CH3COOAg) = ν(CH3COOAg) · M(CH3COOAg) = 0,02 моль · 167 г/моль = 3,34 г.
Вычислим массовую долю ацетата серебра в исходной навеске:
ω(CH3COOAg) = m(CH3COOAg)/m(CH3COOAg + Cu(CH3COO)2) · 100% = 3,34 г/8,8 г · 100% = 37,95%.
Ответ: 37,95%.
Задание 35
При сжигании 3,9 г неизвестного органического вещества было получено 2,7 г воды и 6,72 л углекислого газа (н.у.). Известно, что вещество может реагировать с бромом в соотношениях 1:1, 1:2 и 1:3 по молям. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции данного вещества с 1 моль хлороводорода. (используйте структурные формулы органических веществ).
Решение:
1) Представим молекулярную формулу искомого соединения в виде CxHyOz. Определим количества продуктов его сгорания:
ν(CO2) = V(CO2)/Vm = 6,72 л/22,4 л/моль = 0,3 моль;
ν(H2O) = m(H2O)/M(H2O) = 2,7 г/18 г/моль = 0,15 моль.
Далее определим количества и массы элементов в составе органического вещества:
ν(C) = ν(CO2) = 0,3 моль;
ν(H) = 2ν(H2O) = 2 · 0,15 моль = 0,3 моль;
m(C) = ν(C) · M(C) = 0,3 моль · 12 г/моль = 3,6 г;
m(H) = ν(H) · M(H) = 0,3 моль · 1 г/моль = 0,3 г.
Проверим наличие кислорода в составе органического вещества:
m(O) = m(в-ва) — m(C) — m(H) = 3,9 г — 3,6 г — 0,3 г = 0.
Делаем вывод, что искомое вещество представляет собой углеводород CxHy. Далее определим молекулярную формулу вещества:
x : y = ν(C) : ν(H) = 0,3 : 0,3 = 1 : 1, что дает нам (CH)n.
Для установления индекса n обратимся к описанию в задаче. Из общих соображений понятно, что значение индекса может быть только четным. Это дает нам ряд углеводородов C2H2, C4H4, C6H6 и далее. Поскольку вещество может реагировать с бромом в нескольких целочисленных соотношениях, то можно сделать вывод о наличии нескольких кратных связей в молекуле. Подобные рассуждения приводят нас к значению индекса n=4 и структуре винилацетилена.
Молекулярная формула: C4H4.
2) Структурная формула искомого соединения:
3) Запишем уравнение взаимодействия этого вещества с хлороводородородом:
Тема: «Нахождение молекулярной формулы вещества»
За это задание вы можете получить 3 балла на ЕГЭ в 2022 году
Задача 1
При сжигании 4,35 г органического вещества выделилось 4,48 л (н. у.) углекислого газа и 3,15 г воды. В ходе исследования химических свойств этого вещества установлено, что при его …
Задача 2
При сжигании 3,48 г органического вещества получено 11,16 г смеси оксида углерода(IV) и воды. Количество вещества оксида углерода и воды в продуктах сгорания одинаково. Относительн…
Задача 3
При сгорании 16,2 г органического вещества нециклического строения получили 26,88 л (н. у.) углекислого газа и 16,2 г воды. Известно, что 1 моль этого органического вещества в прис…
Задача 4
При сжигании 22,6 г органического вещества выделилось 13,44 л (н. у.) углекислого газа, 7,2 г воды и 14,6 г хлороводорода. Плотность паров вещества по кислороду 3,531. Вещество реа…
Задача 5
При взаимодействии 3,6 г органического вещества с избытком гидроксида меди(II) при нагревании образовался осадок красного цвета массой 14,4 г.
На основании данных условия задания:
…
Задача 6
При сжигании 0,9 г газообразного органического вещества выделилось 1,76 г углекислого газа, 1,26 г воды и 0,28 г азота. Плотность вещества по азоту — 1,607. В ходе исследования хим…
Задача 7
Массовая доля водорода 3,41, углерода 34,09 %, кислорода 36,36 %, натрия 13,07 % в органическом веществе. Вещество реагирует с гидроксидом натрия с образованием углеводорода.
На ос…
Задача 8
При взаимодействии одного и того же количества алкена с различными галогенами образуется 12,7 г дихлорпроизводного или 21,6 г дибромпроизводного. При взаимодействии алкена с водным…
Задача 9
При сгорании 3 г жидкого (н. у.) органического вещества получили 5,04 л углекислого газа (н. у.) и 2,7 г воды. Известно, что при окислении этого вещества сернокислым раствором перм…
Задача 10
Некоторое органическое вещество содержит водород с массовой долей 9,43 %, массовые доли кислорода и углерода равны. Данное вещество содержит третичный атом углерода и растворяет св…
Задача 11
При сгорании 2,7 г органического вещества получили 3,92 л (н. у.) углекислого газа и 1,8 г воды. Известно, что вещество реагирует с раствором гидроксида натрия, а в реакции с бромн…
Задача 12
При сжигании 4,76 г органического вещества выделилось 6,272 л (н. у.) углекислого газа и 2,52 г воды. Данное вещество подверглось гидролизу в присутствии гидроксида калия c образов…
Задача 13
При сгорании 32,75 г органического вещества А получили 33,6 л углекислого газа (н. у.), 2,8 л азота (н. у.) и 29,25 г воды. Известно, что вещество А можно получить при взаимодейств…
Задача 14
При сжигании 1,27 г органического вещества выделилось 876 мл (н. у.) углекислого газа, 0,54 г воды и 0,73 г хлороводорода. Плотность паров вещества по азоту — 4,536. Вещество реаги…
Задача 15
Плотность паров органического вещества по водороду равна 58. В ходе исследования химических свойств вещества установлено, что при его взаимодействии с водой образуются органическая…
Задача 16
При сгорании 11,6 г органического вещества выделилось 13,44 л (н. у.) углекислого газа и 10,8 мл воды. Плотность паров этого вещества равна 2,59 г/л. Вещество реагирует с гидроксид…
Задача 17
При прокаливании кальциевой соли карбоновой кислоты получили органическое вещество, содержащее 69,76 % углерода и 18,6 % кислорода.
На основании данных условия задания:
- проведите …
Задача 18
При сгорании 18,8 г органического вещества получили 26,88 л (н. у.) углекислого газа и 10,8 мл воды. Известно, что это вещество реагирует как с гидроксидом натрия, так и с бромной …
Задача 19
При сгорании 32,75 г органического вещества А получили 33,6 л углекислого газа (н. у.), 2,8 л азота (н. у.) и 29,25 г воды. Известно, что вещество А можно получить при взаимодейств…
Задача 20
При сжигании 0,9 г газообразного органического вещества выделилось 1,76 г углекислого газа, 1,26 г воды и 0,28 г азота. Плотность вещества по азоту — 1,607. В ходе исследования хим…
1
Теория к заданию 35 по химии: Нахождение молекулярной формулы вещества