Теория к заданию 32 из ЕГЭ по химии
Взаимосвязь различных классов неорганических веществ
Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Единство и многообразие химических веществ этого мира наиболее ярко проявляется в генетической связи веществ, которая отражается в так называемых генетических рядах. Выделим наиболее характерные признаки таких рядов:
1. Все вещества этого ряда должны быть образованы одним химическим элементом. Например, ряд, записанный с помощью следующих формул:
$Br_2 → HBr → NaBr → NaNO_3$,
нельзя считать генетическим, т.к. в последнем звене элемент бром отсутствует, хотя реакция для перехода от $NaBr$ к $NaNO_3$ легко осуществима:
$NaBr + AgNO_3 = AgBr↓+ NaNO_3$.
Этот ряд мог бы считаться генетическим рядом элемента брома, если бы его завершили, например, так:
$Br_2 → HBr → NaBr → AgBr$.
2. Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам, т.е. отражать разные формы его существования.
3. Вещества, образующие генетический ряд одного элемента, должны быть связаны взаимопревращениями. По этому признаку можно различать полные и неполные генетические ряды.
Например, приведенный выше генетический ряд брома будет неполным, незавершенным. А вот следующий ряд:
$Br_2 → HBr → NaBr → AgBr → Br_2$
уже можно рассматривать как полный: он начинался простым веществом — бромом и им же закончился. Обобщая сказанное выше, можно дать следующее определение генетического ряда.
Генетическим называется ряд веществ — представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ или их генезис.
Генетическая связь — понятие более общее, чем генетический ряд, который является пусть и ярким, но частным проявлением этой связи, реализующейся при любых взаимных превращениях веществ. Тогда, очевидно, под это определение подходит и первый приведенный в тексте ряд веществ.
Для характеристики генетической связи неорганических веществ мы рассмотрим три разновидности генетических рядов.
Генетический ряд металла.
Наиболее богат ряд металла, у которого проявляются разные степени окисления. В качестве примера рассмотрим генетический ряд железа со степенями окисления $+2$ и $+3$:
${Fe}{\text»металл»}→{FeCl_2}{\text»соль — хлорид железа(II)»}→{Fe(OH)_2}{\text»основание — гидроксид железа(II)»}→{FeO}{\text»основный оксид — оксид железа(II)»}→{Fe}{\text»металл»}→{FeCl_3}{\text»соль — хлорид железа(III)»}→{Fe(OH)_3}{\text»гидроксид железа (III) — амфотерное соединение с преобладанием основных свойств»}→{Fe_2O_3}{\text»оксид железа(III), аналогичен по свойствам соответствующему гидроксиду»}→{Fe}{\text»металл»}$
Напомним, что для окисления железа в хлорид железа (II) нужно взять более слабый окислитель, чем для получения хлорида железа (III):
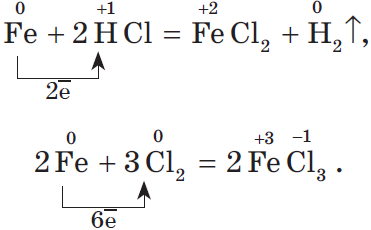
Генетический ряд неметалла.
Аналогично ряду металла более богат связями ряд неметалла с разными степенями окисления, например, генетический ряд серы со степенями окисления $+4$ и $+6$:
${S}{\text»неметалл»}$→${SO_2}{\text»кислотный оксид — оксид серы (IV)»}→{H_SO_3}{\text»сернистая кислота»}→{Na_SO_3}{\text»соль — сульфит натрия»}→{SO_2}{\text»кислотный оксид — оксид серы (IV)»}→{SO_3}{\text»кислотный оксид — оксид серы (VI)»}→{H_SO_4}{\text»серная кислота»}→{SO_2}{\text»кислотный оксид — оксид серы (IV)»}→{S}{\text»неметалл»}$
Затруднение может вызвать лишь последний переход. Руководствуйтесь правилом: чтобы получить простое вещество из окисленного соединения элемента, нужно взять для этой цели самое восстановленное его соединение, например, летучее водородное соединение неметалла. В нашем случае:
${SO_2}{+4}+2H_2{S}{-2}=2H_2O+S{0}↓.$
По этой реакции в природе из вулканических газов образуется сера.
Аналогично для хлора:
Генетический ряд металла, которому соответствуют амфотерные оксид и гидроксид, очень богат связями, т.к. они проявляют в зависимости от условий то кислотные, то основные свойства.
Например, рассмотрим генетический ряд цинка:
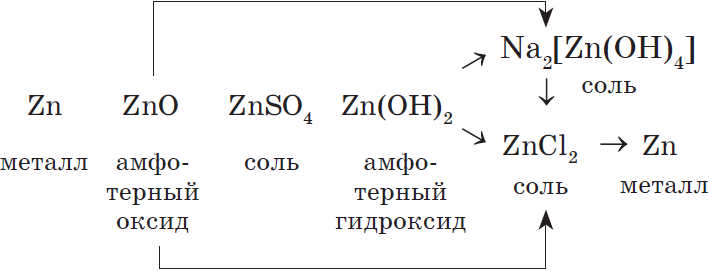
Теория к заданию 25 из ЕГЭ по химии
Качественные реакции на неорганические вещества и ионы
Качественные реакции на катионы и анионы некоторых неорганических веществ
Качественные реакции на анионы.
| Анион | Условие, реактив, катион | Признаки и сокращенное ионное уравнение реакции |
| $Cl^{-}$ | Нитрат серебра $Ag^{+}$ | Белый творожистый осадок:$Ag^{+}+Cl^{-}→AgCl↓$ |
| $Br^{-}$ | Нитрат серебра $Ag^{+}$ | Желтоватый творожистый осадок: $Ag^{+}+Br^{-}→AgBr↓$ |
| $I^{-}$ | Нитрат серебра $Ag^{+}$ | Желтый творожистый осадок: $Ag^{+}+I^{–}→AgI↓$ |
| $SO_4^{2-}$ | Растворимые соли бария $Ba^{2+}$ | Белый осадок: $Ba^{2+}+SO_4^{2-}→BaSO_4↓$ |
| $NO_3^{-}$ | $H_2SO_4(конц)$ и $Cu$ | Выделение бурого газа: $Cu+NO_3^{-}+2H^{+}=Cu^{2+}+NO_2↑+H_2O$ |
| $PO_4^{3-}$ | Нитрат серебра $Ag^{+} | Ярко-желтый осадок:$3Ag^{+}+PO_4^{3-}→Ag_3PO_4↓$ |
| $CrO_4^{2-}$ | Растворимые соли бария $Ba^{2+}$ | Желтый осадок: $Ba^{2+}+CrO_4^{2-}=BaCrO_4↓$ |
| $S^{2-}$ | Растворимые соли меди $Cu^{2+}$ | Черный осадок: $Cu^{2+}+S^{2–}=CuS↓$ |
| $CO_3^{2-}$ | Кислоты $H^{+}$ | Выделение газа без запаха: $2H^{+}+CO_3^{2-}=H_2O+CO_2↑$ |
| $OH^{-}$ | Лакмус | Синий цвет раствора |
| Фенолфталеин | Малиновый цвет раствора | |
| Метиловый оранжевый | Желтый цвет раствора |
Качественные реакции на катионы.
| Катион | Условие, реактив, анион | Признаки, сокращенное ионное уравнение реакции |
| $H^{+}$ | Лакмус | Красный цвет раствора |
| Метиловый оранжевый | Розовый цвет раствора | |
| $NH_4^{+}$ | Щелочь, $OH^{–}$, $t°$ | Выделение газа с резким запахом: $NH_4^{+}+OH^{-}=NH_3↑+H_2O$ |
| $Ag^{+}$ | Соляная кислота, растворы хлоридов, $Cl^{–} | Белый творожистый осадок: $Ag^{+}+Cl^{–}→AgCl↓$ |
| $Li^{+}$ | Пламя | Красное окрашивание |
| $Na^{+}$ | Пламя | Желтое окрашивание |
| $K^{+}$ | Пламя | Фиолетовое окрашивание |
| $Ca^{2+}$ | Пламя | Кирпично-красное окрашивание |
| Растворы карбонатов, $CO_3^{2−}$ | Белый осадок: $Ca^{2+}+CO_3^{2-}→CaCO_3↓$ | |
| $Ba^{2+}$ | Пламя | Желто-зеленое окрашивание |
| Серная кислота, растворы сульфатов, $SO_4^{2−}$ | Белый (мелкокристаллический) осадок: $Ba^{2+}+SO_4^{2-}→BaSO_4↓$ | |
| $Cu^{2+}$ | Пламя | Зеленое окрашивание |
| Вода | Гидратированные ионы $Cu^{2+}$ имеют голубую окраску | |
| Щелочь, $OH^{–}$ | Синий осадок: $Cu^{2+}+2OH^{-}=Cu(OH)_2↓$ | |
| $Fe^{2+}$ | Щелочь, $OH^{–}$ | Зеленоватый осадок: $Fe^{2+}+2OH^{–}=Fe(OH)_2↓$ |
| Красная кровяная соль $K_3, Fe(CN)_6^{3−}$ | Синий осадок (турнбулева синь): $3Fe^{2+}+2^{3-}=Fe_3_2↓$ | |
| $Fe^{3+}$ | Щелочь, $OH^{–}$ | Бурый осадок: $Fe^{3+}+3OH^{–}=Fe(OH)_3↓$ |
| Роданид аммония $NH_4SCN, SCN^{–}$ | Кроваво-красный осадок: $3Fe^{3+}+3CNS^{-}⇄Fe(SCN)_3↓$ | |
| $Fe^{3+}$ | Желтая кровяная соль $K_4$ | Темно-синий осадок (берлинская лазурь): $4Fe^{3+}+3^{4–}=Fe_4_3↓$ |
| $Al^{3+}$ | Щелочь, $OH^{–}$ | Желеобразный осадок белого цвета, растворяется в избытке раствора щелочи: $Al^{3+}+3OH^{–}=Al(OH)_3↓$ |
| Вещество | Реактив, условие | Признаки реакции |
| $CH_2=CH_2$ | Раствор $KMnO_4, H^{+}$ | Обесцвечивание раствора |
| Раствор $Br_2$ | Обесцвечивание раствора | |
| $C_2H_5OH$ | $CuO$ | Изменение цвета проволоки, выделение паров с фруктовым запахом |
| $Cu(OH)_2$ | Образование ярко-синего раствора | |
| Раствор $Br_2$ | Выпадение белого осадка | |
| Раствор $FeCl_3$ | Фиолетовое окрашивание | |
| $Cu(OH)_2, t°$ | Образование красного осадка $Cu_2O$ | |
| $Ag_2O, t°$ | Образование «серебряного зеркала» | |
| $CH_3COOH$ | Лакмус | Красное окрашивание |
| Раствор $Na_2CO_3$ | Выделение газа | |
| $HCOOH$ | Лакмус | Красное окрашивание |
| Раствор $KMnO_4, H^{+}$ | Обесцвечивание раствора | |
| Раствор $Na_2CO_3$ | Выделение газа | |
| $C_{17}H_{33}COOH$ | Раствор $Br_2$ | Обесцвечивание раствора |
| Раствор $KMnO_4$ | Обесцвечивание раствора | |
| $C_{17}H_{35}COONa$ раствор мыла | $H^{+}$ | Образование белых хлопьев |
| $C_{6}H_{12}O_6$ | $Cu(OH)_2$ | Ярко-синее окрашивание; при нагревании образование красного осадка |
| $Ag_2O$ | Образование «серебряного зеркала» | |
| $(C_{6}H_{10}O_5)_n$ крахмал | Раствор $I_2$ | Синее окрашивание |
| Раствор $Br_2$ | Выпадение белого осадка | |
| Белок яичный (раствор) | $HNO_3$ | Образование осадка желтого цвета |
| $Cu(OH)_2$ | Фиолетовое окрашивание |
Ответы ко второй части варианта №25
Задание 30
Zn(ClO3)2 + 12HCl = ZnCl2 + 6Cl2 + 6H2O
5∙ | 2Cl-1 − 2ē → Cl2
1∙ | 2Cl+5 + 10ē → Cl2
хлор в степени окисления -1 (или хлороводород) является восстановителем;
хлор в степени окисления +5 (или хлорат цинка) – окислителем.
Задание 31
Al2(SO4)3 + 3Na2SO3 + 3H2O = 2Al(OH)3 + 3Na2SO4 + 3SO2
2Al3+ + 3SO42- + 6Na+ + 3SO32- + 3H2O = 2Al(OH)3 + 6Na+ + 3SO42- +3SO2
2Al3+ + 3SO32- + 3H2O = 2Al(OH)3 + 3SO2
Задание 32
1) 4Cr(NO3)3 = 2Cr2O3 + 12NO2 + 3O2
2) 4Cu + 2NO2 = 4CuO + N2
3) 2CuO + 4NaI + 2H2SO4 = 2CuI + I2 + 2Na2SO4 + 2H2O
4) I2 + KHS = KI + HI + S
Задание 34
Навеску смеси ацетата серебра и ацетата меди (II) растворили в воде. Полученный раствор массой 88 г подвергли электролизу с инертными электродами и остановили процесс в момент, когда на катоде начал выделяться газ. Масса раствора при этом уменьшилась на 10%. Определите массовую долю ацетата серебра в исходной навеске, если известно, что для поглощения одного из газообразных продуктов электролиза необходимо минимум 89,6 г 5%-ного раствора гидроксида калия. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение:
Запишем уравнения происходящих реакций:
2CH3COOAg = 2Ag + 2CO2 + C2H6 (I)
Cu(CH3COO)2 = Cu + 2CO2 + C2H6 (II)
KOH + CO2 = KHCO3 (III)
Вычислим массу и количество щелочи:
m(KOH) = m(p-pa KOH) · ω(KOH)/100% = 89,6 г · 5%/100% = 4,48 г;
ν(KOH) = m(KOH)/M(KOH) = 4,48 г/56 г/моль = 0,08 моль.
Далее определим количество углекислого газа:
ν(CO2) = ν(KOH) = 0,08 моль.
Рассмотрим данные об изменении массы раствора. Процесс электролиза остановили в момент, когда на катоде начал выделяться газ. Это означает, что электролиз воды в процессе не происходил, а соли израсходовались до конца. Поскольку в ходе электролиза соли полностью переходят в газ и осадок, изменение массы раствора по значению равно сумме масс исходных солей. Вычислим их массу:
Δm = m(p-pa)·10%/100% = 88г · 10%/100% = 8,8 г;
m(CH3COOAg + Cu(CH3COO)2) = Δm = 8,8 г.
Пусть в исходной смеси было х моль ацетата серебра и у моль ацетата меди (II) по массе 167х г и 182у г соответственно. Тогда при их электролизе получилось (х + 2у) моль углекислого газа. Составим и решим систему уравнений:
х + 2у = 0,08
167х + 182у = 8,8
х = 0,08 — 2у
167(0,08 — 2у) + 182у = 8,8
х = 0,08 — 2у
13,36 — 334у + 182у = 8,8
х = 0,08 — 2у
4,56 = 152у
у = 0,03
х = 0,02
ν(CH3COOAg) = 0,02 моль;
ν(Cu(CH3COO)2) = 0,03 моль.
Найдем массу ацетата серебра:
m(CH3COOAg) = ν(CH3COOAg) · M(CH3COOAg) = 0,02 моль · 167 г/моль = 3,34 г.
Вычислим массовую долю ацетата серебра в исходной навеске:
ω(CH3COOAg) = m(CH3COOAg)/m(CH3COOAg + Cu(CH3COO)2) · 100% = 3,34 г/8,8 г · 100% = 37,95%.
Ответ: 37,95%.
Задание 35
При сжигании 3,9 г неизвестного органического вещества было получено 2,7 г воды и 6,72 л углекислого газа (н.у.). Известно, что вещество может реагировать с бромом в соотношениях 1:1, 1:2 и 1:3 по молям. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции данного вещества с 1 моль хлороводорода. (используйте структурные формулы органических веществ).
Решение:
1) Представим молекулярную формулу искомого соединения в виде CxHyOz. Определим количества продуктов его сгорания:
ν(CO2) = V(CO2)/Vm = 6,72 л/22,4 л/моль = 0,3 моль;
ν(H2O) = m(H2O)/M(H2O) = 2,7 г/18 г/моль = 0,15 моль.
Далее определим количества и массы элементов в составе органического вещества:
ν(C) = ν(CO2) = 0,3 моль;
ν(H) = 2ν(H2O) = 2 · 0,15 моль = 0,3 моль;
m(C) = ν(C) · M(C) = 0,3 моль · 12 г/моль = 3,6 г;
m(H) = ν(H) · M(H) = 0,3 моль · 1 г/моль = 0,3 г.
Проверим наличие кислорода в составе органического вещества:
m(O) = m(в-ва) — m(C) — m(H) = 3,9 г — 3,6 г — 0,3 г = 0.
Делаем вывод, что искомое вещество представляет собой углеводород CxHy. Далее определим молекулярную формулу вещества:
x : y = ν(C) : ν(H) = 0,3 : 0,3 = 1 : 1, что дает нам (CH)n.
Для установления индекса n обратимся к описанию в задаче. Из общих соображений понятно, что значение индекса может быть только четным. Это дает нам ряд углеводородов C2H2, C4H4, C6H6 и далее. Поскольку вещество может реагировать с бромом в нескольких целочисленных соотношениях, то можно сделать вывод о наличии нескольких кратных связей в молекуле. Подобные рассуждения приводят нас к значению индекса n=4 и структуре винилацетилена.
Молекулярная формула: C4H4.
2) Структурная формула искомого соединения:
3) Запишем уравнение взаимодействия этого вещества с хлороводородородом:
Тема: «Химическая лаборатория»
За это задание вы можете получить 1 балл на ЕГЭ в 2022 году
Задача 1
Установите соответствие между названием полимера и его классификацией: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ПО… |
Задача 2
Установите соответствие между происхождением полимера и его названием: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ПРОИСХОЖДЕН… |
Задача 3
Установите соответствие между веществом и процессом/оборудованием, который(-ое) используется для его получения: к каждой позиции, обозначенной буквой, подберите соответствующую поз…
Задача 4
Установите соответствие между веществом и способом его промышленного получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕ… |
Задача 5
Установите соответствие между веществом и схемой его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | СХЕМА ПОЛ… |
Задача 6
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТ… |
Задача 7
Установите соответствие между веществом и технологическим приёмом/оборудованием, который(-ое) используется при промышленном получении этого вещества: к каждой позиции, обозначенной…
Задача 8
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТ… |
Задача 9
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТ… |
Задача 10
Установите соответствие между аппаратом и процессом, который в этом аппарате осуществляется: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную …
Задача 11
Установите соответствие между смесью веществ и способом разделения данной смеси: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| С… |
Задача 12
Установите соответствие между природным источником углеводородов и продуктом, полученным в результате его переработки: к каждой позиции, обозначенной буквой, подберите соответствую…
Задача 13
Установите соответствие между веществом и способом его попадания в окружающую среду: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
…
Задача 14
Установите соответствие между лабораторным оборудованием и его применением: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ОБОРУД… |
Задача 15
Установите соответствие между названием полимера и схемой его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ … |
Задача 16
Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТ… |
Задача 17
Установите соответствие между названием процесса переработки нефти и его результатом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.…
Задача 18
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АППАРАТ | ОСУЩЕСТ… |
Задача 19
Установите соответствие между схемой процесса и получаемым продуктом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА ПРОЦЕС… |
Задача 20
Установите соответствие между мономером, используемым в реакции полимеризации, и схемой реакции его получения: к каждой позиции, обозначенной буквой, подберите соответствующую пози…
1
Теория к заданию 26 по химии: Химическая лаборатория