Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции. Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Теперь между правой и левой частями уравнения можно поставить знак равенства:
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:
3. Составим химические формулы полученных веществ по валентностям составных частей:
4
Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:
3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
Алмаз — атомы углерода находятся в вершинах воображаемых тетраэдров;
Графит — атомы углерода находятся в одной плоскости;
Карбин — атомы углерода образуют «нити».
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:
В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
При этом следует учитывать изложенное выше правило о химической связи.
Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях. Зная валентности атома или группы атомов можно составить формулу соединения
Для этого пользуются правилами:
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Если валентности одинаковы, то и число атомов одинаково, т. е. индексы не ставим:
Если валентности кратны (одно число делится на другое), то число атомов элемента с меньшей валентностью определяем делением:
В остальных случаях индексы определяют «крест-накрест»:
Задание 1.4. Составьте химические формулы соединений:
Рейтинг учебников по химии
Наши эксперты выяснили, какое пособие по дисциплине педагоги считают лучшим. При составлении рейтинга учитывались следующие параметры: последовательность тем; понятность определений; наличие разноуровневых заданий для подготовки к ЕГЭ. Каждый из учебников имеет свои особенности.
К критериям отбора качественных пособий относятся:
- Структурированность текста;
- Разнообразие заданий;
- Соответствие ФГОС;
- Качество печати;
- Год издания.
Кроме указанных параметров, мы учли опыт авторов-составителей и дизайн разделов. Интерактивные формы со схемами, знаками, таблицами способствуют качественному усвоению материала.
Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
- свежее молоко стало кислым;
- зелёные листья стали жёлтыми;
- сырое мясо при обжаривании изменило запах.
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
- обязательно изменяется состав или строение молекул;
- никогда не изменяется состав и заряд ядер атомов.
В этом определении встречаются такие понятия, как «вещество», «молекула», «атом». Разберём их подробнее.
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
- Н2О — вода;
- Na8[(AlSiO4)6SO4] — лазурит.
Выше приведены молекулярные формулы двух веществ. Следует отметить, что далеко не все вещества состоят из молекул, так как существуют вещества, которые состоят из атомов или ионов. Например, алмаз состоит из атомов углерода, а обычная поваренная соль — из ионов Na+ и ионов Cl– (условная «молекула» — NaСl).
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
- Н — атом водорода;
- О — атом кислорода.
Число атомов в молекуле обозначают при помощи индекса:

Примеры:
- О2 — это молекула вещества кислорода, состоящая из двух атомов кислорода;
- Н2О — это молекула вещества воды, состоящая из двух атомов водорода и одного атома кислорода.
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:

Аналогично изображают число молекул:
- 2Н2 — две молекулы водорода;
- 3Н2О — три молекулы воды.
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
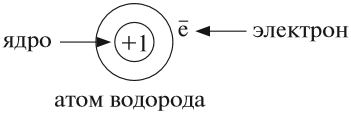
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород».
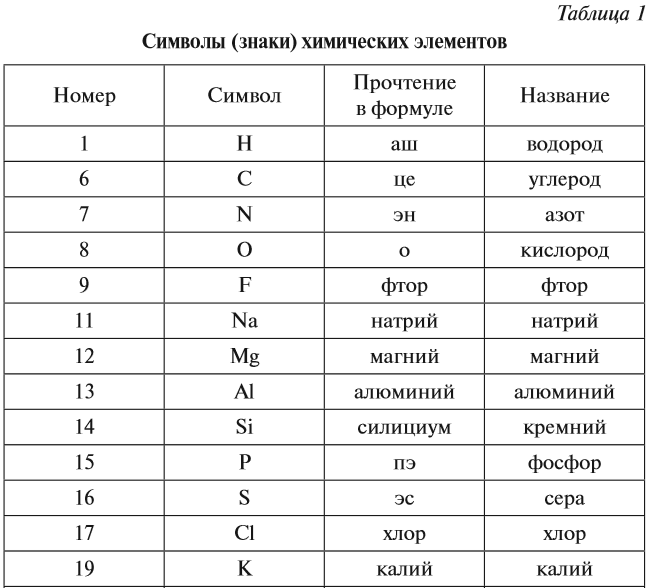
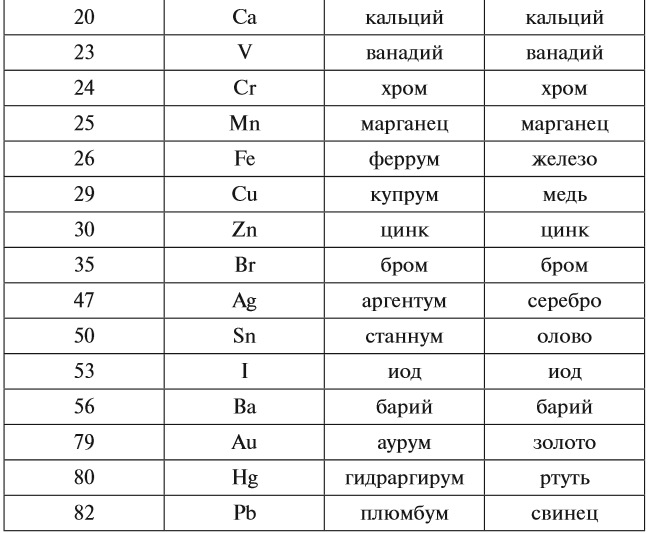
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
Вопрос. А чем отличаются химические формулы веществ:
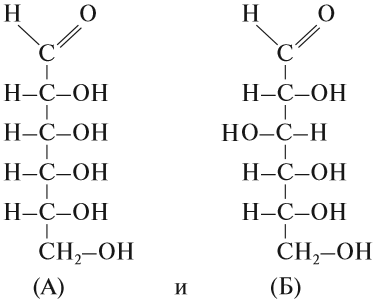
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.

Как учиться в домашних условиях
Если хотите подтянуть химию в домашних условиях, то проще и правильнее будет заниматься вместе с преподавателем онлайн.
Уроки с репетитором.
Он оценивает уровень знаний ребенка и составляет индивидуальный план. Занятия проводятся через Скайп: школьник и учитель общаются в режиме реального времени, работают на интерактивной доске. Педагог сразу же отвечает на все вопросы, при необходимости еще раз объясняет сложную тему, указывает на ошибки.
Стоимость онлайн-уроков ниже, чем встречи с преподавателем офлайн, но не уступают им по качеству.
Онлайн-курсы.
Самый эффективный способ выучить химию, подойдет для тех, кто хочет заниматься по индивидуальному графику. Уроки проводят в режиме реального времени и записывают. Если вы не сможете подключиться к онлайн-занятию, то посмотрите видеоурок в личном кабинете в любое время.
Все видеозаписи, конспекты лекций, презентации и другие учебные материалы будут доступны ученику и после курса. Вопросы можно задавать на онлайн-уроке или писать в чат куратору.
Подобрать курс по химии также можно на нашем сайте в детском разделе.
Для вашего удобства, приведем ссылки для разных классов:
- Курсы по химии для 7 класса.
- Курсы по химии для 8 класса.
- Курсы по химии для 9 класса.
- Курсы по химии для 10 класса.
- Курсы по химии для 11 класса.
Преимущества учебы в онлайн-школах:
- Учебный план включает подробный разбор всех тем. Школьники изучают основы химии, физические и химические свойства элементов, учатся составлять уравнения реакций и решать задачи. Преподаватели проводят эксперименты онлайн — ученик наблюдает за каждым действием.
- Теорию закрепляют на практике. После каждого урока нужно сделать домашнее задание. Периодически проводятся контрольные работы и проверочные тесты.
- Родители получают отчеты об успехах ребенка каждый месяц.
Как быстро и легко выучить химию с нуля
Как можно ускорить и облегчить процесс, если вы изучаете химию с нуля:
- Ведите конспекты по каждому параграфу, составляйте таблицы, схемы, графики. Это поможет легко выучить основные определения по химии и собрать все важные формулы, реакции, законы в одном месте.
- Найдите подходящую учебную литературу. Если хотите вспомнить всю школьную программу, то начинайте с учебников за 7 класс – желательно, чтобы текст был написан понятным языком, с примерами. Если нужно повторить материал за 8-9 класс, чтобы подготовиться к ОГЭ или ЕГЭ, пользуйтесь пособиями, которые составлены или одобрены экспертами ФИПИ.
- Регулярно проверяйте себя. Можно решать задания из сборников, проходить онлайн-тесты на знание неорганической и аналитической химии. Чем чаще вы будете тренироваться, тем быстрее запомните основные алгоритмы решения химических задач.
Далее расскажем подробнее, как выучить или повторить химию за месяц, неделю или день.
На нашем сервисе собран список школ с курсами подготовки к ОГЭ и ЕГЭ по химии.
За 1-2 месяца
Если вам нужно вспомнить пройденный материал, чтобы написать годовую контрольную на отлично, то подготовку можно начать за месяц. Но если предстоит сдавать ОГЭ или ЕГЭ, то 2-3 месяцев не хватит, чтобы полноценно выучить всю программу по химии с нуля.
Что делать, если до сдачи экзамена остается не больше 8-10 недель:
- Изучите официальные документы. На сайте ФИПИ есть кодификатор, спецификация, демоверсия с заданиями – в них содержится вся важная информация: структура экзамена, темы, примеры вопросов, требования.
- Выделите на подготовку не менее 4-5 часов в неделю. Если хотите получить высокий балл, заниматься нужно регулярно и интенсивно. Составьте расписание и чек-лист.
- Решите пробник ОГЭ/ЕГЭ и посмотрите, какие темы или задачи вызывают наибольшие затруднения – их разбирайте в первую очередь.
Еще один эффективный способ, как можно выучить химию за короткий срок, – это экспресс-курсы. В онлайн-школах есть специальные программы, состоящие из видеоуроков в записи, вы сможете смотреть их 2 и даже 3 раза в неделю. Доступ к новому занятию открывается после сдачи домашней работы по предыдущей теме. Например, видеокурс «Неорганическая химия: практикум для 8-11 классов» от школы «Фоксфорд» включает 8 занятий – его можно пройти за пару недель.
За неделю
Что можно сделать за неделю:
- Выучить базовую теорию по химии: свойства веществ, особенности протекания реакций (например, «металлы + кислоты», «металлы + щелочи» и пр.), цепочки и схемы превращений в органической химии и пр.
- Научиться решать хотя бы простые задачи. Если времени остается мало, то разберите основные алгоритмы. Если готовитесь к ОГЭ/ЕГЭ, то вам помогут демонстрационные версии 2021 года.
- Если сдаете экзамен, тренируйтесь выполнять тесты. Тестирование можно пройти, к примеру, на сервисе «Яндекс.Репетитор». Это поможет набрать хотя бы минимальный балл.
Реально ли подтянуть знания в более короткие сроки
За 1, 2 или 3 дня можно подтянуть знания по химии, если сдаете итоговую работу в четверти. Но если вам предстоит написать годовую контрольную, ОГЭ или ЕГЭ, то подготовку надо начинать заранее – хотя бы за несколько недель/месяцев.
Накануне экзамена можно позаниматься 2-3 часа, почитать лекции, посмотреть решение задач. Но не стоит сидеть над учебниками весь день и тем более ночь – вы только сильнее запутаетесь.
Хватит ли года, чтобы понять все темы с 7 по 11 класс
Год – это достаточный срок, чтобы разобраться по всех разделах химии. 5 рекомендаций школьникам, как изучать химию:
- Выучите периодическую систему Менделеева – разберитесь, в какой последовательности расположены элементы в таблице, что означают цифры и обозначения у каждого вещества и т. д.
- Запомните основные термины и понятия – электролитическая диссоциация, валентность, окислительно-восстановительные реакции, гидролиз, электролиз и др.
- Ищите примеры химических явлений в повседневной жизни. Узнайте, какие безопасные опыты можно проводить в домашних условиях из подручных средств.
- Занимайтесь не только по учебникам. При обучении вам помогут научно-популярные видео на Youtube, статьи в журналах и пр.
- Сначала разберитесь с теорией, а затем приступайте к практике. Если вы неоднократно допускаете одну и ту же ошибку в заданиях, значит, плохо понимаете тему – еще раз прочитайте параграф, посмотрите примеры задач, при необходимости обратитесь за помощью к старшим, например, к преподавателю.
Выучить школьный предмет за год легче всего на онлайн-курсах – многие из них длятся с сентября до мая-июня. На занятиях помогут понять химию, подготовят к ОГЭ 9 класса или к ЕГЭ. Например, в онлайн-школе «Фоксфорд» есть углубленные программы, подготовительные и просто развивающие кругозор, например, «Эксперименты и химия вокруг нас».
Как выбрать учебник по химии
Определитесь с целью обучения и уровнем знаний. Если известны простые вещества, переходите к сложным; от воды до спиртов и эфиров. Зависит от того, нужна тема для классной работы или домашнего обучения; тема изучается впервые или повторяется. Мы подготовили список критериев выбора.
Соответствие ФГОС
Федеральный государственный образовательный стандарт – образец программы обучения, которому следуют школы, вузы, колледжи. Чтобы знания соответствовали экзаменационным критериям, узнайте элементы, прописанные в кодификаторе ФИПИ. Дополнительная литература не гарант заданного школьного образования, но одна из вариативных частей государственной программы.
Стандарт определяется по трём аспектам: программе, условию, результату. Выявить соответствие информации ФГОС легко по печати на издании либо сверив с кодификатором. Гарантировано постепенное продвижение по образовательным ступеням. Дополнительная литература закрепляет и расширяет полученные знания.
Структурированность
12 заданий в ЕГЭ посвящено общей химии, 7 – неорганической, 9 – органической. Из них 4 задания во второй части. Для подготовки берите учебники, которые способны дать теорию к этим заданиям.
На базовом уровне изучают амины, аминокислоты, белки. На профильном представлены нитросоединения, анилин, пептиды, структура белков, пиррол, пиридин, пиримидиновые и пуриновые основания. Отслеживайте наличие этих тем в выбранных учебниках. В структуре они должны подаваться последовательно.
Доступность подачи материала
Наглядность и доступность прослеживаются в компактном способе подачи материала. На определённом этапе можно вернуться к неизученным или непонятным положениям.
Нестандартные задачи формируют изобретательность, творческое мышление, умение упрощать формулы, создавая новые решения. Необычные задания бывают простыми словесными, среднего уровня, олимпиадными. Игровой формат материала мотивирует к углублённому изучению химии, увеличивает удовольствие от получения знаний. Отдавайте предпочтение иллюстрированным, детальным пособиям.
Разнообразие заданий
Химические задания делятся на пять видов: тестовые, расчётные, качественные, экспериментальные, комбинированные. Основные цели задач – составление и решение химических уравнений, демонстрация теории на практике.
Все эти виды есть в школьной программе ФГОС. Задания из дополнительных пособий должны соответствовать системе ГИА.

Лучшие учебники по алгебре
10 класс
01.Введение в органическую химию
01.Предмет органической химии. Роль органических веществ в жизни человека02.Качественный и количественный состав органических веществ. Простейшая и молекулярная формулы03.Изомерия. Виды изомерии. Структурная изомерия, геометрическая, оптическая04.Решение задач на определение состава органических веществ05.История развития представлений о строении вещества06.Электронное строение атома углерода07.Геометрия молекул. Понятие о теории гибридизации08.Ковалентная связь в органических соединениях09.Решение задач на определение строения органических веществ
02.Тема Предельные углеводороды
01.Природные источники углеводородов. Переработка нефти02.Роль метана в парниковом эффекте03.Бензин. Октановое число. Способы повышения октанового числа04.Алканы. Строение молекул, номенклатура, физические свойства05.Алканы. Химические свойства. Радикальное замещение на примере реакции галогенирования06.Алканы. Химические свойства. Реакции с изменением углеродного скелета07.Алканы. Методы получения. Применение08.Циклоалканы. Особенности малых циклов09.Примеры задач на тему Алканы и циклоалканы
03.Тема Непредельные углеводороды
01.Алкены. Химические свойства -1. Электрофильное присоединение02.Алкены. Химические свойства -2. Получение и применение алкенов03.Каучук и резина04.Полимеры. Каучук05.Алкины. Строение, изомерия, физические свойства, получение06.Алкины. Химические свойства и применение
04.Тема Ароматические углеводороды
01.История развития представлений о строении бензола. Понятие об ароматичности02.Арены. Номенклатура, изомерия, получение и физические свойства03.Химические свойства бензола04.Химические свойства производных бензола. Применение ароматических углеводородов05.Ароматические углеводороды. Строение, физические свойства, номенклатура06.Ароматические углеводороды. Химические свойства07.Ориентационные эффекты заместителей. Методы получения и синтезы на основе ароматических углеводородов
05.Тема Спирты
01.Спирты. Классификация спиртов. Предельные одноатомные спирты строение и номенклатура02.Химические свойства спиртов — 1. Кислотность спиртов03.Химические свойства спиртов — 2. Нуклеофильное замещение в спиртах04.Химические свойства спиртов — 3. Окисление спиртов05.Особенности химических свойств многоатомных спиртов и фенолов06.Получение и применение спиртов
06.Тема Карбонильные соединения. Карбоновые кислоты
01.Карбонильные соединения. Строение, изомерия, номенклатура02.Химические свойства альдегидов и кетонов03.Карбоновые кислоты. Строение, физические свойства, номенклатура04.Химические свойства предельных одноосновных карбоновых кислот05.Муравьиная, уксусная, щавелевая и жирные кислоты. Особенности свойств06.Получение и применение карбоновых кислот07.Примеры задач по химии спиртов, альдегидов и карбоновых кислот08.Производные карбоновых кислот. Сложные эфиры09.Жиры. Строение, химические свойства, функции в организме
07.Тема Углеводы
01.Углеводы. Классификация и состав углеводов02.Моносахариды на примере глюкозы. Строение глюкозы03.Физические и химические свойства глюкозы04.Олиго- и полисахариды. Сахароза. Гидролиз сахарозы. Крахмал05.Целлюлоза. Искусственные полимеры
08.Тема Амины
01.Аминосоединения. Классификация, изомерия, названия и физические свойства02.Химические свойства аминов. Основность аминов03.Особенности свойств анилина. Получение и применение аминов
09.Тема Белки и нуклеиновые кислоты
01.Аминокислоты. Названия и свойства аминокислот
02.Белки03.Понятие о гетероциклических соединениях04.Нуклеиновые кислоты05.Решение качественных задач по органической химии06.Решение качественных задач-2. Цепочки превращений
Лучшие учебники по химии для подготовки к ЕГЭ
С помощью молярной массы, постоянной Авогадро, выхода продукта, стехиометрического коэффициента можно выводить другие формулы и решать любые задания. Интересные и сложные задачи в профильных учебниках сформируют привычку к разным формулировкам. Экзамен уже не будет страшен.
Команда ВыборЭксперта.ру проанализировала 10 пособий, выбрав 2 наиболее актуальных и подробных для подготовки к ЕГЭ.
Химия. Справочник для старшеклассников и поступающих в вузы. Свердлова, Карташов, Радугина
Справочник отличается систематизированным теоретическим материалом по общей, органической и неорганической химии. По каждой теме предоставлены вопросы и упражнения трёх уровней сложности в соответствии с особенностями ЕГЭ
Особое внимание уделено методике решения расчётных и качественных задач. Лаконичная подача материала в таблицах, схемах и алгоритмах экономит время на поиск и повторение материала
Из 1500 упражнений более 850 – типовые задачи, 200 взяты в различных вузах из билетов прошлых лет. Приведена 1000 тестов для итоговой оценки знаний. Они адресованы абитуриентам вузов химического, химико-технического, биологического, медицинского профилей. Справочник полезен не только будущим студентам, но и преподавателям.
Последнюю версию выпустило издательство “АСТ-Пресс” в 2019 году в серии “Справочники”. Твёрдый переплёт и 576 страниц характеризуют массивность книги и количество вложенных знаний.
Достоинства:
- Подробное оглавление, предметный указатель;
- Экспериментальные задачи, упражнения от того же автора;
- Написан педагогами прикладной, теоретической химии;
- Практические методики по решению качественных и расчётных задач;
- Обобщения теории в таблицах, схемах, алгоритмах;
- Образцы решения задач усложнённых и типовых вариантов.
Недостатки:
- Тонкая бумага, шрифт с засечками, переплёт не проклеен;
- Нет таблицы Менделеева, сухая подача информации.
Химия. Углубленный курс подготовки к ЕГЭ. Еремин, Дроздов, Рыжова
Материал разделён на три части: общая, неорганическая и органическая химия. Теория по всем темам школьного курса оформлена по традиционной схеме – с примерами, заданиями для самоконтроля. Наглядное, чёткое изложение материала со схемами, рубриками и выделенными терминами экономит время на повторение, развивает визуальную память.
Примеры и вопросы составлены по актуальной версии года издания, но включены и задания других типов. Данный в сжатой, концентрированной форме материал не копирует учебники, а учит комплексно и последовательно применять знания на практике. К тестовым и расчётным заданиям даны ответы.
Большой опыт авторов-составителей в сфере педагогики вложен в этот учебник и преподнесён не только старшеклассникам и абитуриентам, но и учителям с репетиторами.
Достоинства:
- Актуальное издание 2020 года;
- Курс составлен преподавателями химического факультета МГУ им. М. В. Ломоносова;
- Подробное оглавление, приложение и задания с ответами в конце справочника;
- Качественный шрифт и отлично проработанный дизайн.
Недостатки:
- Сухая подача материала;
- Высокая цена.
Много заданий с ответами для самостоятельного решения. Высокое качество полиграфии обусловлено твёрдой проклеенной обложкой и крепкими страницами.
Лучшие учебники по физике
Преимущества изучения химии в онлайн-режиме
Онлайн-уроки по химии характеризуются целым перечнем плюсов, к которым можно отнести следующее:
- Доступное изложение материала – процесс обучения построен таким образом, чтобы ребенку было интересно осваивать химию дальше.
- Использование новых методик обучения – начинают, как правило, от простого к сложному. Поэтому на начальном этапе предлагается ознакомиться с базовой информацией, которая включает основы органической и неорганической химии, а затем переходить к решению уравнений и задач различной степени сложности.
- Возможность воспользоваться услугами репетитора, тьютора – предоставляются на платной основе.
Если в качестве профильного предмета для поступления в высшее учебное заведение выбрана химия, бесплатные онлайн-уроки помогут в кратчайшие сроки подготовиться к вступительным экзаменам и дальнейшему усвоению новых знаний. А также это хорошее подспорье для тех, кому не под силу изучение этой дисциплины в рамках школьной программы.
Химия 8 класс. Основные темы
Введение
§ 1. Химия — часть естествознания
§ 2. Предмет химии. Вещества
§ 3. Превращения веществ. Роль химии в жизни человека
§ 4. Краткий очерк о истории развития химии
§ 5. Периодическая система химических элементов Д. И. Менделеева. Знаки химических элементов
§ 6. Химические формулы. Относительная атомная и молекулярная массы
Глава первая. Атомы химических элементов
§ 7. Основные сведения о строении атомов
§ 8. Изменения в составе ядер атомов химических элементов. Изотопы
§ 9. Строение электронных оболочек атомов
§ 10. Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов
§ 11. Взаимодействие атомов элементов-неметаллов между собой
§ 12. Ковалентная полярная химическая связь
§ 13. Металлическая химическая связь
Глава вторая. Простые вещества
§ 14. Простые вещества — металлы
§ 15. Простые вещества — неметаллы
§ 16. Количество вещества
§ 17. Молярный объём газов
Глава третья. Соединения химических элементов
§ 18. Степень окисления
§ 19. Важнейшие классы бинарных соединений — оксиды и летучие водородные соединения
§ 20. Основания
§ 21. Кислоты
§ 22. Соли
§ 23. Кристаллические решётки
§ 24. Чистые вещества и смеси
§ 25. Массовая и объёмная доли компонентов смеси (раствора)
Глава четвёртая. Изменения, происходящие с веществами
§ 26. Физические явления в химии
§ 27. Химические реакции
§ 28. Химические уравнения
§ 29. Расчёты по химическим уравнениям
§ 30. Реакции разложения
§ 31. Реакции соединения
§ 32. Реакции замещения
§ 33. Реакция обмена
§ 34. Типы химических реакций на примере свойств воды
Глава пятая. Растворение. Растворы. Реакции ионного обмена
§ 35. Растворение. Растворимость веществ в воде
§ 36. Электролитическая диссоциация
§ 37. Основные положения теории электролитической диссоциации
§ 38. Ионные уравнения
§ 39. Кислоты, их классификация и свойства
§ 40. Основания, их классификация и свойства
§ 41. Оксиды, их классификация и свойства
§ 42. Соли, их классификация и свойства
§ 43. Генетическая связь между классами веществ
§ 44. Окислительно-восстановительные реакции
Рекомендуемые материалы для очного контроля знаний
по предмету «Химия 8 класс»:
- Контрольно-измерительные материалы по химии 8 класс / Н.П.Троегубова, Е.Н.Стрельникова — М.:ВАКО, 2016
- Химия. 8 класс. Тетрадь для оценки качества знаний. Габриелян О.С., Купцова А.В. (2015, 112с.)
- Химия. 8 класс. Контрольные и проверочные работы. Габриелян О.С. и др. (2014, 224с.)
- Химия в тестах, задачах, упражнениях. 8 класс. Габриелян О.С., Смирнова Т.В., Сладков С.А. (2014, 224с.)
- Контрольные и самостоятельные работы по химии. 8 класс: к учебнику Габриеляна О.С. — Павлова Н.С. (2015, 256с.)
- Тесты по химии. 8 класс. Первоначальные химические понятия… К учебнику Рудзитиса Г.Е., … (2013, 144с.)
- Тесты по химии. 8 класс. Периодический закон и периодическая система… К учебнику Рудзитиса Г.Е., …(2013, 96с.)
- Химия 8 класс. Тесты. В 2 ч. Ким Е.П. (2011; 64с., 64с.)
- Химия 8 класс. Экспресс-диагностика. Расулова Г.Л. (2014, 112с.)
Перейти на Главную страницу сайта.