9 класс
02.Периодический закон и Периодическая система химических элементов Д.И. Менделеева
01.Попытки классификации химических элементов. Открытие периодического закона03.Становление в науке представлений о строении атома04.Состав атомных ядер. Изотопы05.Электронные оболочки атома. Атомные модели Бора06.Описание элемента по положению в Периодической системе элементов Д.И. Менделеева
03.Химическая связь. Электролитическая диссоциация
01.Ионная связь02.Ковалентная связь03.Ковалентная полярная связь04.Закономерности изменения электроотрицательности элементов в группе и периоде05.Схемы образования веществ с различным типом связи06.Электролитическая диссоциация07.Реакции ионного обмена08.Условия протекания реакций ионного обмена до конца09.Составление уравнений реакций ионного обмена10.Физические свойства веществ с различным типом связи11.Повторение и обобщение темы Химическая связь. Электролитическая диссоциация12.Решение расчетных задач по уравнению реакции
04.Окислительно-восстановительные реакции
01.Развитие в науке представлений об окислении и восстановлении02.Окисление и восстановление03.Степень окисления
04.Окислительно-восстановительные реакции05.Составление уравнений окислительно-восстановительных реакций06.Обобщение темы Окислительно-восстановительные реакции07.Расчёты массы вступившего в реакцию металла по объёму выделившегося водорода
05.Химия металлов
01.Общие свойства металлов. Металлическая связь02.Элементы подгруппы А I группы03.Элементы подгруппы А II группы04.Жесткость воды05.Свойства алюминия06.Применение алюминия и его сплавов07.Свойства железа08.Применение железа и его сплавов09.Металлургия10.Расчеты массы металлов, полученных из руд, содержащих примеси11.Обобщение темы Химия металлов12.Расчеты массы полученного вещества, если известно содержание примесей в исходном веществе
06.Химия неметаллов
01.Свойства элементов и простых веществ галогенов02.Химические свойства соединений галогенов03.Сера. Сероводород и сульфиды04.Кислородосодержащие соединения серы05.Свойства элемента и простого вещества азота06.Аммиак и соли аммония07.Оксиды азота08.Азотная кислота и ее соли09.Фосфор и его соединения10.Углерод11.Неорганические соединения углерода12.Соединения кремния и их свойства13.Силикатные материалы14.Решение расчетных задач по теме Неметаллы15.Обобщение темы Химия неметаллов
07.Органические вещества
01.Распознавание неорганических веществ с помощью характерных реакций02.Углеводороды03.Кислородсодержащие органические вещества04.Жиры и углеводы05.Азотсодержащие органические соединения06.Аминокислоты. Белки07.Обобщение темы Органические вещества
Лучшие учебники по химии для подготовки к ЕГЭ
С помощью молярной массы, постоянной Авогадро, выхода продукта, стехиометрического коэффициента можно выводить другие формулы и решать любые задания. Интересные и сложные задачи в профильных учебниках сформируют привычку к разным формулировкам. Экзамен уже не будет страшен.
Команда ВыборЭксперта.ру проанализировала 10 пособий, выбрав 2 наиболее актуальных и подробных для подготовки к ЕГЭ.
Химия. Справочник для старшеклассников и поступающих в вузы. Свердлова, Карташов, Радугина
Справочник отличается систематизированным теоретическим материалом по общей, органической и неорганической химии. По каждой теме предоставлены вопросы и упражнения трёх уровней сложности в соответствии с особенностями ЕГЭ
Особое внимание уделено методике решения расчётных и качественных задач. Лаконичная подача материала в таблицах, схемах и алгоритмах экономит время на поиск и повторение материала
Из 1500 упражнений более 850 – типовые задачи, 200 взяты в различных вузах из билетов прошлых лет. Приведена 1000 тестов для итоговой оценки знаний. Они адресованы абитуриентам вузов химического, химико-технического, биологического, медицинского профилей. Справочник полезен не только будущим студентам, но и преподавателям.
Последнюю версию выпустило издательство “АСТ-Пресс” в 2019 году в серии “Справочники”. Твёрдый переплёт и 576 страниц характеризуют массивность книги и количество вложенных знаний.

Достоинства:
- Подробное оглавление, предметный указатель;
- Экспериментальные задачи, упражнения от того же автора;
- Написан педагогами прикладной, теоретической химии;
- Практические методики по решению качественных и расчётных задач;
- Обобщения теории в таблицах, схемах, алгоритмах;
- Образцы решения задач усложнённых и типовых вариантов.
Недостатки:
- Тонкая бумага, шрифт с засечками, переплёт не проклеен;
- Нет таблицы Менделеева, сухая подача информации.
Химия. Углубленный курс подготовки к ЕГЭ. Еремин, Дроздов, Рыжова
Материал разделён на три части: общая, неорганическая и органическая химия. Теория по всем темам школьного курса оформлена по традиционной схеме – с примерами, заданиями для самоконтроля. Наглядное, чёткое изложение материала со схемами, рубриками и выделенными терминами экономит время на повторение, развивает визуальную память.
Примеры и вопросы составлены по актуальной версии года издания, но включены и задания других типов. Данный в сжатой, концентрированной форме материал не копирует учебники, а учит комплексно и последовательно применять знания на практике. К тестовым и расчётным заданиям даны ответы.
Большой опыт авторов-составителей в сфере педагогики вложен в этот учебник и преподнесён не только старшеклассникам и абитуриентам, но и учителям с репетиторами.

Достоинства:
- Актуальное издание 2020 года;
- Курс составлен преподавателями химического факультета МГУ им. М. В. Ломоносова;
- Подробное оглавление, приложение и задания с ответами в конце справочника;
- Качественный шрифт и отлично проработанный дизайн.
Недостатки:
- Сухая подача материала;
- Высокая цена.
Много заданий с ответами для самостоятельного решения. Высокое качество полиграфии обусловлено твёрдой проклеенной обложкой и крепкими страницами.

Лучшие учебники по физике
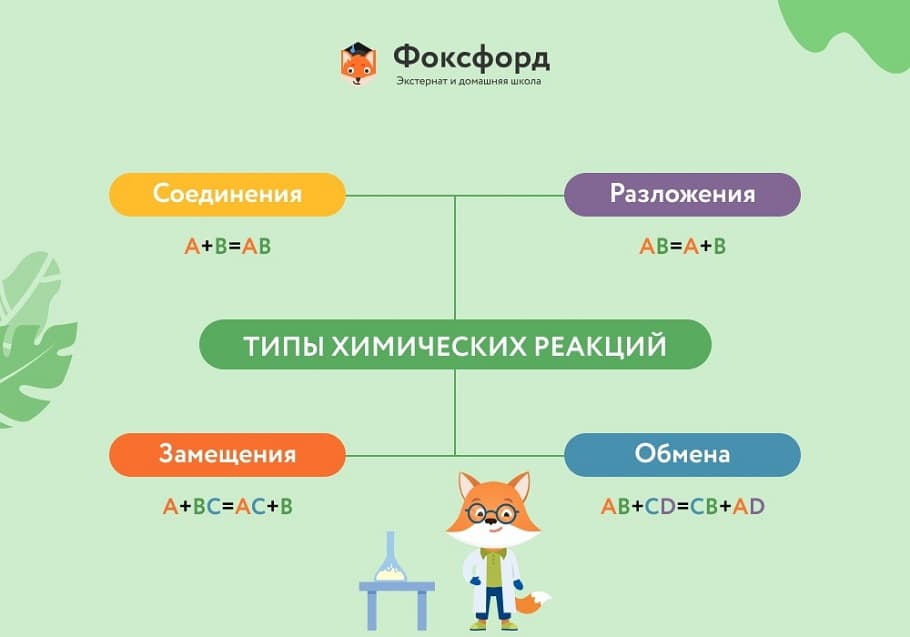
Виды химических реакций
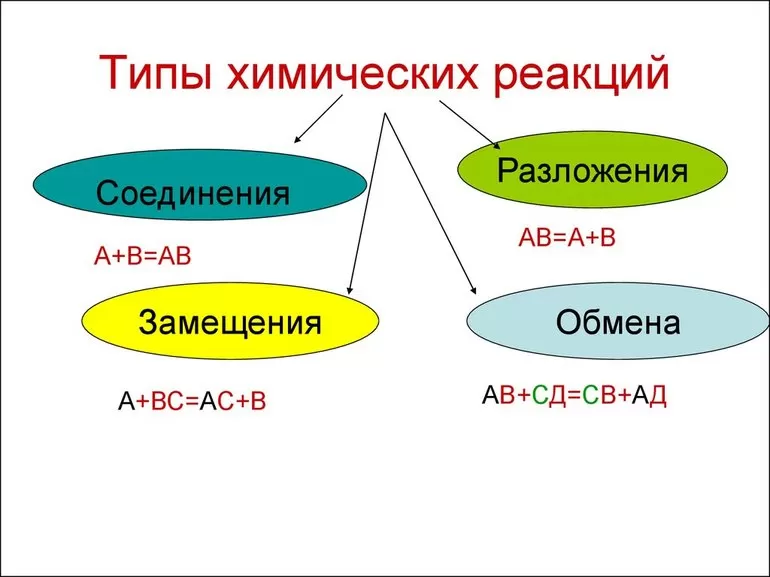
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
Соединение. Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
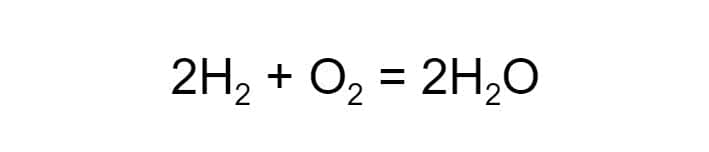
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
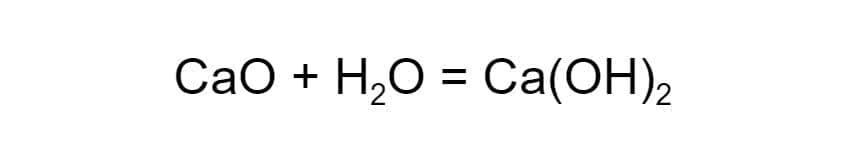
Разложение. Обратный процесс: одно вещество распадается на несколько более простых. Например, если нагреть известняк, получаются негашёная известь и углекислый газ:
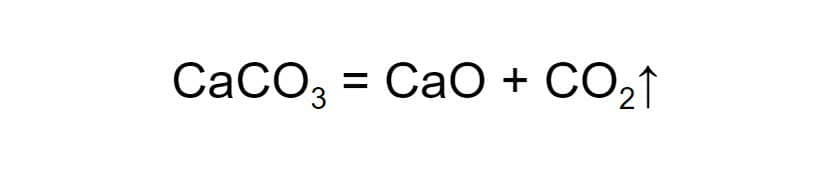
Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
Замещение. В реакции участвуют два вещества — простое и сложное. Если атомы химического элемента в простом веществе более активны, они замещают атомы одного из менее активных химических элементов в составе сложного вещества.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:
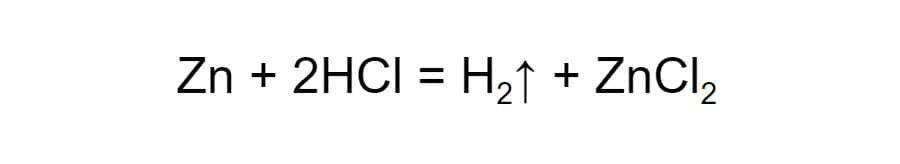
Обмен. Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
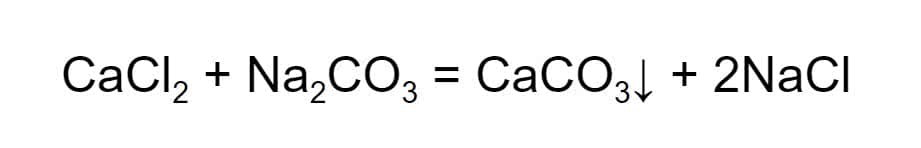
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Гидролиз солей
Попробуйте ответить на вопрос: изменится ли окраска лакмуса в растворе серной кислоты? гидроксида натрия? сульфата натрия? карбоната натрия? В первых двух случаях можно уверенно сказать «да», так как при диссоциации образуются:
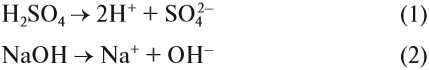
ионы водорода (уравнение 1) или гидроксид-анионы (уравнение 2), а индикаторы реагируют именно на избыток ионов Н+ или ОН–. Но при диссоциации упомянутых солей:
ионы Н+ и ОН– не образуются! Тем не менее раствор карбоната натрия изменяет окраску индикатора, а сульфата натрия — нет! Почему? Видимо, причина в том, что ионы карбоната натрия вступают в какую-то реакцию с молекулами воды, ведь только из молекулы воды может образоваться избыток Н+ или ОН–.
Гидролиз солей — это процесс взаимодействия ионов соли с молекулами воды, в результате чего изменяется рН раствора.
Какой ион карбоната натрия реагирует с водой? Предположим, что оба. Тогда в растворе происходят процессы:
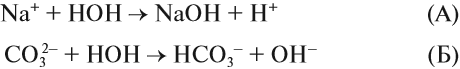
Вспомните, что такое «сильный электролит», «слабый электролит», и ответьте на вопрос: какой из этих процессов (А или Б) НЕВОЗМОЖЕН в растворе?
Очевидно, невозможен процесс (А), так как молекул сильного электролита NаОН в растворе НЕТ, есть только ионы Na+ и ОН–, другими словами, связывания ионов не происходит.
Следовательно, происходит процесс (Б), и краткое ионномолекулярное уравнение гидролиза карбоната натрия выглядит так:

pH > 7, среда щелочная, лакмус синий.
И действительно, в растворе карбоната натрия лакмус становится синим. Почему именно карбонат-анион вступает в реакцию гидролиза? Потому что это ион, соответствующий СЛАБОМУ электролиту и в результате его взаимодействия с водой образуется СЛАБЫЙ электролит (вспомните условия протекания ионных процессов).
Вывод. Гидролизу подвергаются соли, содержащие остаток слабого электролита.
Например:
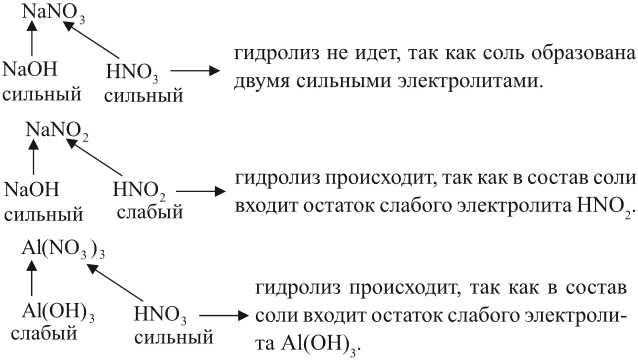
Задание 6.12. Определите, происходит ли гидролиз в растворах хлорида железа (III), силиката натрия, нитрата калия. Ответ поясните.
Алгоритм составления уравнений реакции гидролиза:
1. Определить какие электролиты образуют соль, отметить их силу:
2. Составить уравнение диссоциации соли, подчеркнуть ион, соответствующий слабому электролиту:
3. Для иона слабого электролита составить уравнение реакции взаимодействия с одной молекулой воды (уравнение гидролиза):
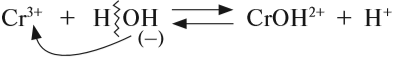
- из молекулы воды притягивается противоположно заряженный нон, в данном случае ОН–;
-
сумма зарядов до и после реакции равна:
4. Определить реакцию среды в образовавшемся растворе: в данном случае образовались ионы Н+, значит, среда кислая, рН< 7.
Вопрос. Какую окраску будет иметь лакмус в этом растворе?
5. Для того чтобы составить молекулярное уравнение реакции гидролиза, следует:
- дописать к каждому иону ионы, которые образуются при диссоциации, с противоположным зарядом (в данном случае ионы Cl–);
-
составить полученные формулы по валентности (валентность = заряду иона!):
Задание 6.13. Составить уравнения реакций гидролиза для: сульфата алюминия; силиката калия; хлорида натрия; нитрата меди (II); сульфида калия.
Задание 6.14. Как при помощи лакмуса различить бесцветные растворы солей: нитрата свинца (II), сульфата калия, сульфида натрия?
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов
Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Понятие о рН (водородном показателе)
Вода — очень слабый электролит: при обычных условиях лишь одна молекула воды из 10 000 000 распадается на ионы:
Это уравнение показывает, что при диссоциации 1 моль молекул воды образуется 1 моль ионов водорода Н+ и 1 моль гидроксид-анионов ОН–. Другими словами: в чистой воде концентрация ионов водорода равна концентрации гидроксид-анионов:
Здесь: — равновесная концентрация ионов водорода, моль/л; — равновесная концентрация гидроксид-анионов, моль/л.
Такой раствор (среда) называется «нейтральный».
Характер среды — кислый, нейтральный — можно оценить количественно при помощи рН («пэ-аш»). Водородный показатель рН равен логарифму концентрации ионов водорода, взятому с обратным знаком*:
Поэтому в случае чистой воды рН = 7.
Раствор, у которого рН = 7, называется нейтральным.
Если к чистой воде добавили кислоту, то увеличили концентрацию ионов водорода. Теперь эта концентрация составит, например 10–6 моль/л или 10–2 моль/л.
Такая среда (раствор) называется «кислая», или «кислотная». Причём в первом случае (рН = 6) среда считается слабокислой, а во втором (рН = 2) — сильнокислой, т. е. в любом случае рН < 7. Значение рН можно измерять и с большей точностью (например, рН = 5,36).
pН < 7, среда кислая.
При добавлении щёлочи увеличивается концентрация ионов ОН–, и одновременно уменьшается концентрация ионов Н+. Дело в том, что для любого водного раствора
Поэтому, если концентрация ионов ОН– составит 10–3, то = 10–11, т. е.
рН > 7, среда щелочная.
Определить реакцию среды конкретного раствора можно при помощи индикаторов.
Индикаторы — это вещества, которые изменяют свой цвет в присутствии избытка ионов Н+ или ОН–.
Ионы Н+ или ОН– действуют на молекулу индикатора, и индикатор меняет цвет по-разному в зависимости от реакции среды и вида самого индикатора (табл. 7).
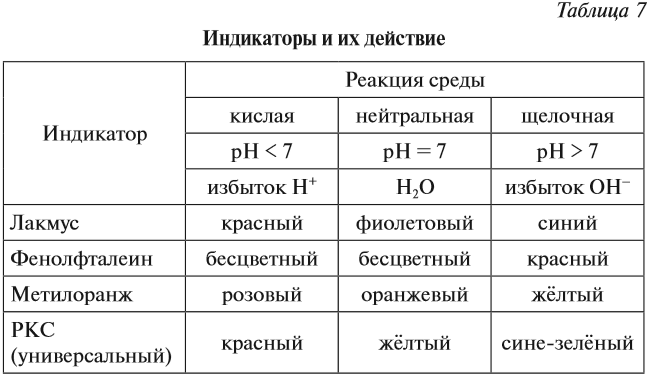
Задание 6.10. Какую окраску будет иметь индикатор лакмус, если:
- рН < 7;
- = 10–4 моль/л;
- в растворе есть избыток ОН–;
- рН = 7;
- = 10–8 моль/л;
- в растворе есть НNО3;
- = 0,1 моль/л.
Окраска индикаторов изменяется в растворах, которые содержат избыток одного из этих ионов. Ионы Н+ или ОН– могут образовываться в ходе диссоциации некоторых соединений.
Вопрос. Какие вещества при диссоциации образуют ионы Н+ или ОН–?
Эти ионы могут образовываться при диссоциации растворимых кислот, оснований, некоторых кислых и основных солей. Например, дигидрофосфат натрия образует при диссоциации ионы водорода, а гидрофосфат натрия — нет. Дело в том, что кислые соли могут диссоциировать ступенчато, если полученный на первой стадии анион соответствует сильному электролиту:
остаток слабого электролита → диссоциация не идёт;
остаток сильного электролита → диссоциация идёт:
Образуются ионы Н+, возникает кислая среда.
Кроме того, ионы Н+ или ОН– могут образовываться в ходе взаимодействия некоторых веществ с водой. Например, с водой могут взаимодействовать активные металлы, кислотные и основные оксиды.
Задание 6.11. Какую окраску будет иметь индикатор лакмус, если в воде растворить: кальций, оксид лития, оксид серы (IV)?

Основы органической химии
Органическая химия выделена в отдельный подвид благодаря тому, что объектом ее изучения является все, в составе чего есть углерод.
Как оказалось, углерод чаще всего образует соединения со следующими элементами — H, N, O, S, P. Кстати, эти элементы называются органогенами.
Органические соединения, количество которых сегодня достигает 20 млн, очень важны для полноценного существования всех живых организмов. Впрочем, никто и не сомневался, иначе человек просто закинул бы изучение этого непознанного в долгий ящик.
 Чтобы хотя бы минимально понять органическую химию, приготовьтесь много читать
Чтобы хотя бы минимально понять органическую химию, приготовьтесь много читать
Цели, методы и теоретические представления органической химии представлены следующим:
- Разделение ископаемого, животного или растительного сырья на отдельные вещества;
- Очистка и синтез разных соединений;
- Выявление структуры веществ;
- Определение механики протекания химических реакций;
- Нахождение зависимости между структурой и свойствами органических веществ.
Онлайн-учебники
Собственная википедия «Фоксфорда». Мы собрали всю школьную программу и немного больше в лаконичную структуру из отдельных статей. В учебнике есть понятные иллюстрации, видео-тьюториалы, возможность сохранять избранные статьи и много другое. И так по всем предметам — не только по химии.
Справочник, который в 2006 году выпустил Томский государственный университет. «Неорганическая химия» — базовый раздел, с которого начинается изучение химии в восьмом классе, поэтому ресурс пригодится для подготовки к ОГЭ, ЕГЭ и олимпиадам.
Больше нужен олимпиадникам и старшеклассникам, которые готовятся к ЕГЭ: органическая химия начинается только в конце девятого класса. Однако в ОГЭ есть один вопрос из органики, поэтому девятиклассникам учебник тоже пригодится.
Сборник авторских лекций, которые подготовил профессор Южного федерального университета Сергей Иванович Левченков. Отличный ресурс для того, чтобы понять логику науки: в какой последовательности происходили самые важные открытия в химии и как они связаны между собой.
Химическая википедия. Этому ресурсу можно доверять, потому что разработчики перевели в электронный вид хорошие справочники по химии. Также они сделали удобный поиск по сайту.
Ещё одно преимущество «Химика» — сервисы, которые помогают школьникам разобраться в сложных темах с помощью наглядных схем. Вот два самых важных из них:
Приложение для проверки своих знаний по строению атома: вводите символ элемента и приложение сразу выдаёт все возможные записи электронной конфигурации его атома.

Сервис помогает разобраться, какие вещества реагируют друг с другом, при каких условиях и что образуется в результате. Например, если ввести в строку поиска уравнение Cl2 + NaOH, можно получить все возможные реакции этих соединений с коэффициентами.
С чего начать учить химию
Химия – одна из наиболее сложных школьных дисциплин. Физические и химические свойства элементов, особенности протекания реакций между различными веществами, валентность, электролитическая диссоциация и многое другое – все это школьники должны знать и понимать.
3 рекомендации, с чего лучше начать учить химию:
- Определить свой уровень знаний – от этого будет зависеть план обучения. К примеру, если вы не разбираетесь даже в основах химии, то придется учить весь материал с нуля – с таблицы Менделеева. Если хорошо знаете предмет, но планируете поступать на медфак или химфак, то химию лучше изучать углубленно, за рамками школьной программы.
- Решить, как будете заниматься – самостоятельно, с репетитором или на онлайн-курсах. В первом случае нужно выбрать учебники, рабочие тетради, найти задачники (желательно с ответами), составить план и т. д. В двух других случаях вам не придется делать этого самому – у преподавателя уже есть готовая учебная программа и материалы для обучения.
- Подумать, как будете делать лабораторные работы. Химия – это не только теория, но и практика. Не всегда уроков в школе хватает, чтобы научиться проводить химические опыты.
Простые вещества
Если вещества состоят из атомов одного вида, то они относятся к простым веществам.
Простыми называются вещества, которые образованы атомами одного химического элемента.
Простые вещества — одна из форм существования химических элементов в природе. Простые вещества, состоящие из молекул, относятся к веществам молекулярного строения. При обычных условиях среди них есть газы (водород, кислород, азот, фтор, хлор, благородные газы), жидкости (бром) и твердые вещества (сера, иод, фосфор).
Элемент кислород существует в виде двух простых веществ молекулярного строения: одно из них (просто кислород) состоит из двухатомных молекул, а второе (озон) — из трехатомных.
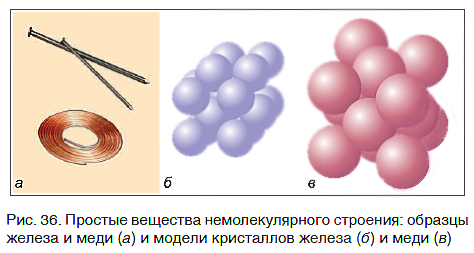
Связываясь друг с другом, атомы образуют не только молекулы. Гораздо больше простых веществ, которые имеют немолекулярное строение. Они обычно представляют собой твердые кристаллические вещества, построенные из атомов, например кристаллы алмаза, графита, меди, железа (рис. 36).
Современные методы аналитической химии
Изучение современных методов химического анализа имеет ряд преимуществ. Они оперативные, точные, многопрофильные, имеют специальные контрольные параметры и позволяют сравнивать результат со стандартом.
Кроме того, они имеют отличную воспроизводимость и низкий предел получение положительного результата — обнаружения конкретного компонента.
К востребованным в современном химическом деле относятся виды анализов:
- спектральные;
- электрохимические;
- оптические;
- хроматографические;
- основанные на электрофорезе;
- инструментальные, в основе которых лежит физико-химические реакции и свойства.
Как учиться в домашних условиях
Если хотите подтянуть химию в домашних условиях, то проще и правильнее будет заниматься вместе с преподавателем онлайн.
Уроки с репетитором.
Он оценивает уровень знаний ребенка и составляет индивидуальный план. Занятия проводятся через Скайп: школьник и учитель общаются в режиме реального времени, работают на интерактивной доске. Педагог сразу же отвечает на все вопросы, при необходимости еще раз объясняет сложную тему, указывает на ошибки.
Стоимость онлайн-уроков ниже, чем встречи с преподавателем офлайн, но не уступают им по качеству.
Онлайн-курсы.
Самый эффективный способ выучить химию, подойдет для тех, кто хочет заниматься по индивидуальному графику. Уроки проводят в режиме реального времени и записывают. Если вы не сможете подключиться к онлайн-занятию, то посмотрите видеоурок в личном кабинете в любое время.
Все видеозаписи, конспекты лекций, презентации и другие учебные материалы будут доступны ученику и после курса. Вопросы можно задавать на онлайн-уроке или писать в чат куратору.
Подобрать курс по химии также можно на нашем сайте в детском разделе.
Для вашего удобства, приведем ссылки для разных классов:
- Курсы по химии для 7 класса.
- Курсы по химии для 8 класса.
- Курсы по химии для 9 класса.
- Курсы по химии для 10 класса.
- Курсы по химии для 11 класса.
Преимущества учебы в онлайн-школах:
- Учебный план включает подробный разбор всех тем. Школьники изучают основы химии, физические и химические свойства элементов, учатся составлять уравнения реакций и решать задачи. Преподаватели проводят эксперименты онлайн — ученик наблюдает за каждым действием.
- Теорию закрепляют на практике. После каждого урока нужно сделать домашнее задание. Периодически проводятся контрольные работы и проверочные тесты.
- Родители получают отчеты об успехах ребенка каждый месяц.
Какой учебник по химии лучше
На основе сравнения достоинств, недостатков, актуальности информации, наличия гдз команда ВыборЭксперта.ру выбрала 4 издания для подготовки к экзаменам и углубления знаний по химии:
- Для изучения азов подойдёт учебник 8 класса Габриелян.
- Начала органики кратко и интересно описаны в учебнике 9 класса Рудзитис.
- Если нужен профильный учебник химии, рекомендуем материалы Ерёмина за 11 класс.
- Вдогонку к учебнику возьмите углублённый справочник Ерёмина для отработки и повторения теории.
Основываясь на критериях выбора, наших рекомендациях, составьте личный список литературы. Указанных книг достаточно для освоения общей, неорганической и органической химии на профильном уровне.
Свойства таблицы Менделеева
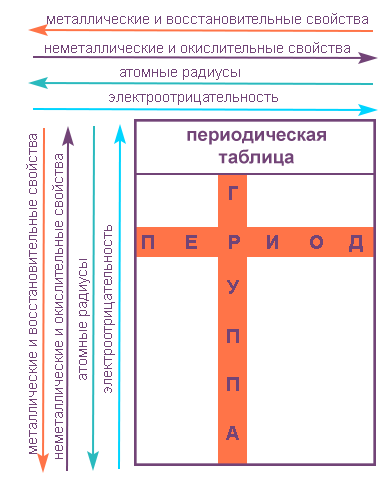
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Как быстро и легко выучить химию с нуля
Как можно ускорить и облегчить процесс, если вы изучаете химию с нуля:
- Ведите конспекты по каждому параграфу, составляйте таблицы, схемы, графики. Это поможет легко выучить основные определения по химии и собрать все важные формулы, реакции, законы в одном месте.
- Найдите подходящую учебную литературу. Если хотите вспомнить всю школьную программу, то начинайте с учебников за 7 класс – желательно, чтобы текст был написан понятным языком, с примерами. Если нужно повторить материал за 8-9 класс, чтобы подготовиться к ОГЭ или ЕГЭ, пользуйтесь пособиями, которые составлены или одобрены экспертами ФИПИ.
- Регулярно проверяйте себя. Можно решать задания из сборников, проходить онлайн-тесты на знание неорганической и аналитической химии. Чем чаще вы будете тренироваться, тем быстрее запомните основные алгоритмы решения химических задач.
Далее расскажем подробнее, как выучить или повторить химию за месяц, неделю или день.
На нашем сервисе собран список школ с курсами подготовки к ОГЭ и ЕГЭ по химии.
За 1-2 месяца
Если вам нужно вспомнить пройденный материал, чтобы написать годовую контрольную на отлично, то подготовку можно начать за месяц. Но если предстоит сдавать ОГЭ или ЕГЭ, то 2-3 месяцев не хватит, чтобы полноценно выучить всю программу по химии с нуля.
Что делать, если до сдачи экзамена остается не больше 8-10 недель:
- Изучите официальные документы. На сайте ФИПИ есть кодификатор, спецификация, демоверсия с заданиями – в них содержится вся важная информация: структура экзамена, темы, примеры вопросов, требования.
- Выделите на подготовку не менее 4-5 часов в неделю. Если хотите получить высокий балл, заниматься нужно регулярно и интенсивно. Составьте расписание и чек-лист.
- Решите пробник ОГЭ/ЕГЭ и посмотрите, какие темы или задачи вызывают наибольшие затруднения – их разбирайте в первую очередь.
Еще один эффективный способ, как можно выучить химию за короткий срок, – это экспресс-курсы. В онлайн-школах есть специальные программы, состоящие из видеоуроков в записи, вы сможете смотреть их 2 и даже 3 раза в неделю. Доступ к новому занятию открывается после сдачи домашней работы по предыдущей теме. Например, видеокурс «Неорганическая химия: практикум для 8-11 классов» от школы «Фоксфорд» включает 8 занятий – его можно пройти за пару недель.
За неделю
Что можно сделать за неделю:
- Выучить базовую теорию по химии: свойства веществ, особенности протекания реакций (например, «металлы + кислоты», «металлы + щелочи» и пр.), цепочки и схемы превращений в органической химии и пр.
- Научиться решать хотя бы простые задачи. Если времени остается мало, то разберите основные алгоритмы. Если готовитесь к ОГЭ/ЕГЭ, то вам помогут демонстрационные версии 2021 года.
- Если сдаете экзамен, тренируйтесь выполнять тесты. Тестирование можно пройти, к примеру, на сервисе «Яндекс.Репетитор». Это поможет набрать хотя бы минимальный балл.
Реально ли подтянуть знания в более короткие сроки
За 1, 2 или 3 дня можно подтянуть знания по химии, если сдаете итоговую работу в четверти. Но если вам предстоит написать годовую контрольную, ОГЭ или ЕГЭ, то подготовку надо начинать заранее – хотя бы за несколько недель/месяцев.
Накануне экзамена можно позаниматься 2-3 часа, почитать лекции, посмотреть решение задач. Но не стоит сидеть над учебниками весь день и тем более ночь – вы только сильнее запутаетесь.
Знакомство с химией
Когда мы слышим слово «химия», сразу представляем человека, окружённого колбами, пробирками, наполненными веществами всевозможных цветов. Он записывает непонятные символы, которые нам кажутся иероглифами. Перед нами встает вопрос: что это за наука, какие задачи изучает? Ответ достаточно прост, предмет химии – вещества.
Химия — наука о веществах, их свойствах и превращениях в другие вещества.
Как и каждая наука, химия имеет свою историю развития. Первые химические знания появились до нашей эры, в Древнем Египте. Египтяне обладали химической наукой, которую называли «Священным искусством». Некоторые рецепты приготовления парфюмерии и лекарственных препаратов используют и до сих пор. Наверняка вы слышали об алхимиках и философском камне, с помощью которого, можно превратить любой металл в золото.
В современном представлении термин «химия» можно услышать в нескольких интерпретациях: химия как наука, а также продукты химического производства (одним словом химия). Мы не представляем наше существование без химических веществ. Просыпаясь утром, идём умываться: мыло, зубная паста ждут нас в ванной комнате. Ароматный чай и хрустящие хлопья на завтрак. Одежда, обувь, школьные принадлежности и многое другое мы получаем благодаря химическим технологиям.
Но также можно сказать, что химия – это вред. Неоднократно слышали о кислотных дождях, о гибели морских жителей из-за нефтяных пятен, о нитратах в овощах и фруктах и т. д.
Химия тесно связана с человечеством, является неотъемлемой его частью. Чтобы не наносить вред нашей планете, необходимо применять химические знания и рационально использовать вещества.
Именно благодаря своей многогранности химия применяется в каждой области:
- Медицина: лекарственные препараты, вакцины, искусственные органы, косметические средства;
- Искусство: живопись, архитектура, фотографии, изготовление ювелирных изделий, ковка, литье;
- Сельское хозяйство: удобрение, средства для борьбы с вредителями;
- Криминалистика: опознание личности по ДНК, отпечаткам пальцев, определение состава ядовитых и взрывчатых веществ;
- Строительство: производство строительных материалов, обработка древесины;
- Металлургия: без металлов не существует ни одна отрасль. Металлы и сплавы окружают нас повсюду;
- В быту: средство бытовой химии, при приготовлении обеда также применяем химические знания;
- Пищевая промышленность: молочная, мясная продукция, соусы, кондитерские изделия и т. д.;
- Охрана окружающей среды. На данный момент остро стоит проблема охраны окружающей среды. Деятельность человека губительно действует на планету. Но с помощью химических знаний, которые базируются на свойствах веществ, учёные находят способы очистки воды, почвы, воздуха от вредных веществ.
 (Источник)
(Источник)
Химия – наука очень обширная и включает в себя много разделов, которые имеют своё назначение и изучают вещества, их строение и свойства.
- Неорганическая химия или её ещё называют химия неживой природы. Предмет изучения химические элементы и их соединения;
- Биохимия изучает процессы, которые происходят в организмах при обмене веществ, дыхании и т. д.;
- Органическая химия или химия углерода. Это увлекательный раздел знакомит о множестве соединений, благодаря уникальным свойствам углерода;
- Физическая химия рассматривает закономерности реакций;
- Аналитическая химия, благодаря качественному и количественному анализу позволяет исследовать смеси.
Чтобы овладеть химическими знаниями, необходимо изучить физику, биологию, а также математику. Как видно из схемы, химия тесно перекликается с другими науками.
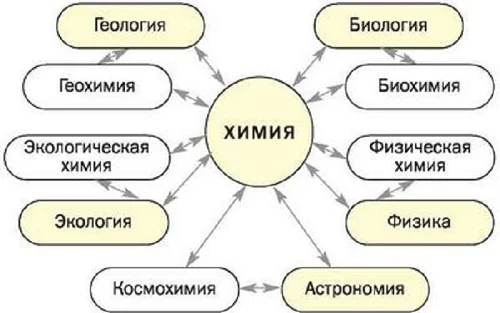
Выводы
Растворы — это однородная смесь двух или более компонентов. При образовании растворов в результате сольватации происходит дробление растворяемого вещества до молекул или ионов.
Истинный раствор — это однородная смесь молекул и ионов различных веществ.
Электролиты это вещества, которые в водных растворах распадаются на ионы (диссоциируют). Уравнения реакций для таких веществ составляют с учётом этого процесса в ионно-молекулярной форме. Реакции ионного обмена, в том числе гидролиз, осуществимы, если происходит связывание ионов, т. е. образуется осадок, газ или слабый электролит.






