Куда поступить, если интересно химическое направление в учебе и работе
Выпускникам 9-х классов в случае их интереса к химии стоит рассматривать профильные колледжи с химическим уклоном.
У одиннадцатиклассников есть 2 варианта продолжения учебы:
- средне-специальное учебное заведение;
- высшее учебное заведение.
Так как для поступления в вуз нужны высокие баллы по ЕГЭ и, к сожалению для школьников, не только по любимому предмету, попасть в высшее учебное заведение на бюджет, удается далеко не всем желающим. В таком случае остается вариант обучения в вузе на платном отделении или же получение средне-специального образования в ссузе.
Последний вариант едва ли не самый удачный:
- Вступительных экзаменов нет.
- Длительность обучения по окончании 11 класса составляет всего 1-3 года.
- После окончания можно учиться в вузе по сокращенной программе обучения.
О средне-специальных учебных заведениях с химическим уклоном и поговорим.
Как запомнить таблицу Менделеева
При первом взгляде на знаменитую таблицу многих берет оторопь. Однако не спешите думать, что это «китайская грамота». Гениальность таблицы в том, что она в сжатой форме как будто концентрирует в себе всю основную информацию о химических элементах и о том, как они будут взаимодействовать друг с другом.
Поэтому, если вы изучите таблицу Менделеева, универсальная «шпаргалка» по химии будет всегда с вами, и вы будете сожалеть, что нет таких замечательных таблиц по другим предметам.
Приступая к изучению этой прекрасной таблицы, не стремитесь освоить всю ее сразу. Дайте себе время на поэтапное изучение. Держите таблицу под рукой, чтобы понемногу повторять в свободнее время.
Часть элементов вы и так знаете. Для сложных названий можно подбирать ассоциации, например, совпадения с именами, рифму и прочие хитрости мнемотехники.
Химия при поступлении в медицинский вуз
Для абитуриентов, подавших документы в медицинский вуз, химия – профилирующий предмет, по которому придется пройти вступительное испытание. Во многих университетах есть требования по минимальным результатам ЕГЭ, минимум 50 баллов.
Решение врачом/химиком/фармацевтом созрело давно? Нужно подумать о поступлении заранее – участвовать в олимпиадах, проходить подготовительные курсы. Это даст дополнительное преимущество при подаче документов и поможет на экзаменах.
Чем престижнее вуз, тем сложнее в него поступить. Те, кто выбирает университеты Москвы, Санкт-Петербурга, Смоленска или Курска должны быть готовы к большому конкурсу. Сибирские «вышки» в Томске или Хабаровске отличаются высоким уровнем преподавания, но из-за территориальной удаленности поступить в них проще.
Как найти репетитора по химии?
Безусловно, изучение химии через интернет позволяет повысить уровень знаний ребенка. Не все дети одинаково усваивают новую информацию: запоминают формулы, алгоритм решения задач. По этой причине в отдельных ситуациях могут понадобиться услуги специалиста по химии.
Услуга подбора репетитора бесплатная, но занятие с педагогом являются платными. Весьма важным моментом выступает то, что не так легко отыскать высококвалифицированного специалиста, который сможет доступно преподнести даже самый сложный материал. На сайте можно подобрать опытного репетитора, который обеспечит нужный уровень подготовки ребенка.
Также вас может заинтересовать:
Куда можно поступить
Естественно-научный профиль в школе позволяет пробовать силы на химико-биологических и медицинских специальностях.
Школьник сможет участвовать во Всероссийской олимпиаде школьников, Менделеевском конкурсе, различных биологических и химических турнирах — призёрство или победа на олимпиадах дают бонусы для поступления.
Варианты, куда поступить, варьируются в зависимости от окончательного набора предметов ЕГЭ. Список вузов и специальностей можно посмотреть на информационном портале mos.ru. Вот некоторые варианты, которые считаются топовыми:
- МГУ: для поступления на биологический факультет понадобится комбинация из химии, биологии и профильной математики. Ученица 11 класса домашней онлайн-школы «Фоксфорда» Маша Журавлёва недавно делилась опытом подготовки.
- МГМУ им. И.М. Сеченова: пользуются популярностью фармацевтический, педиатрический, лечебный, стоматологический и другие естественно-научные факультеты.
- МФТИ: физика требуется на большинство специальностей.
- РНИМУ им. Пирогова: один из ведущих «медов» России, «конкурент» Сеченовки.
- НИУ ВШЭ: хотя университет известен экономической подготовкой, здесь есть факультет физики, факультет химии и факультет биологии и биотехнологии. Студенты ведут исследования на базе институтов РАН.
- МГТУ им. Баумана: ведущий вуз для технарей, особенно физиков.
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
Алмаз — атомы углерода находятся в вершинах воображаемых тетраэдров;
Графит — атомы углерода находятся в одной плоскости;

Карбин — атомы углерода образуют «нити».
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
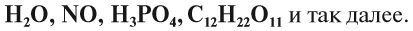
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:

В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).

Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
При этом следует учитывать изложенное выше правило о химической связи.

Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
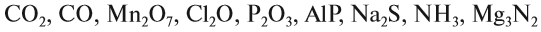
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
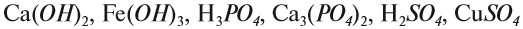
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях. Зная валентности атома или группы атомов можно составить формулу соединения
Для этого пользуются правилами:
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Если валентности одинаковы, то и число атомов одинаково, т. е. индексы не ставим:
Если валентности кратны (одно число делится на другое), то число атомов элемента с меньшей валентностью определяем делением:
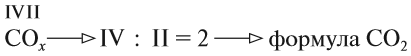
В остальных случаях индексы определяют «крест-накрест»:
Задание 1.4. Составьте химические формулы соединений:
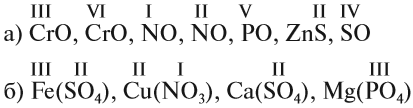

Виртуальные лаборатории
Российский портал, на котором эксперименты из школьной программы можно смоделировать онлайн.
Международный ресурс, которые разрабатывают учёные со всего мира. Позволяет ставить более серьёзные опыты.
Проект по доставке на дом наборов для экспериментов. Также на сайте есть подробные и корректные инструкции по выполнению опытов. Многие ингредиенты для этих опытов можно самостоятельно купить в аптеке или продовольственном магазине. В дополнение к опытам на Mel Science полезно смотреть видео, которые объясняют суть химических явлений.
На портале есть множество полезных статей, подробные разборы опытов, инструкции, как проводить их в домашних условиях и где брать для них реактивы.
Какие необязательные предметы будут в 7 классах с 2021 года
В предстоящем учебном году школьникам необходимо будет посещать и необязательные предметы. Какие из них вводить, учебные заведения выбирают самостоятельно. Сейчас в их перечень включены:
- родной язык и литература — в его рамках изучаются только российские писатели и становление русской речи;
- второй иностранный язык — французский/немецкий/английский/китайский наиболее распространены, но в школах могут изучаться и иные;
- ОБЖ — проводится или на протяжении года, или одним курсом за 1,5-2 недели;
- статистика — решение сложных задач, выявление закономерности, работа с базами данных;
- краеведение — знакомство учеников с историей развития местности, где расположено учебное заведение;
- экология — изучение особенностей окружающей среды и влияния на нее происходящих катастроф;
- личностное развитие — заключается в работе над собой, выявлении сильных и слабых сторон, определении истинных интересов;
- проектирование — изучение особенностей работы индивидуально и в команде, разработка личного проекта.
Кроме того, на неделе придется найти время для классного часа для решения накопившихся за неделю вопросов класса с руководителем. Многие школы организуют элективы, где в рамках курса ученики посещают стандартные предметы для подготовки к предстоящим итоговым аттестациям/экзаменам.
Преимущества изучения химии в онлайн-режиме
Онлайн-уроки по химии характеризуются целым перечнем плюсов, к которым можно отнести следующее:
- Доступное изложение материала – процесс обучения построен таким образом, чтобы ребенку было интересно осваивать химию дальше.
- Использование новых методик обучения – начинают, как правило, от простого к сложному. Поэтому на начальном этапе предлагается ознакомиться с базовой информацией, которая включает основы органической и неорганической химии, а затем переходить к решению уравнений и задач различной степени сложности.
- Возможность воспользоваться услугами репетитора, тьютора – предоставляются на платной основе.
Если в качестве профильного предмета для поступления в высшее учебное заведение выбрана химия, бесплатные онлайн-уроки помогут в кратчайшие сроки подготовиться к вступительным экзаменам и дальнейшему усвоению новых знаний. А также это хорошее подспорье для тех, кому не под силу изучение этой дисциплины в рамках школьной программы.
Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции. Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Теперь между правой и левой частями уравнения можно поставить знак равенства:
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
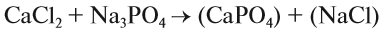
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:
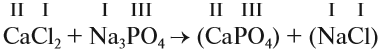
3. Составим химические формулы полученных веществ по валентностям составных частей:
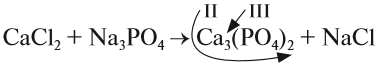
4
Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
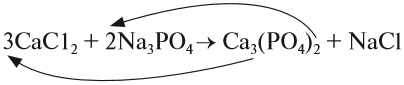
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
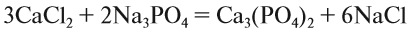
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
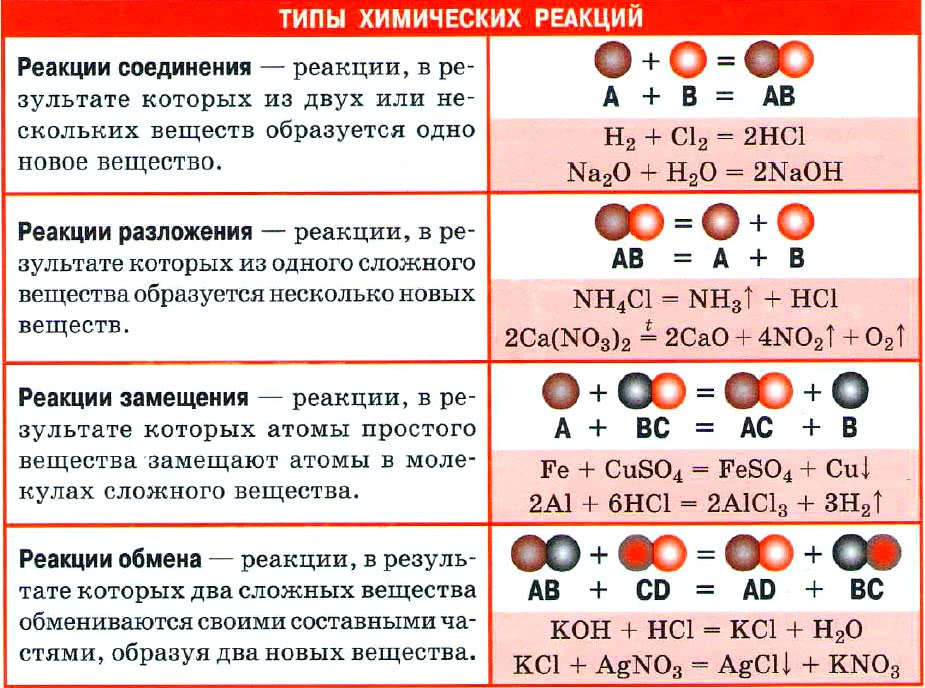
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:
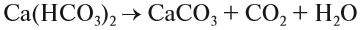
3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
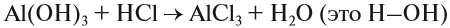
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
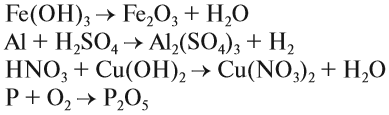

Химические формулы веществ немолекулярного строения
А если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2. Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2. Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3.
Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей.
Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора. Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д.
Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы.
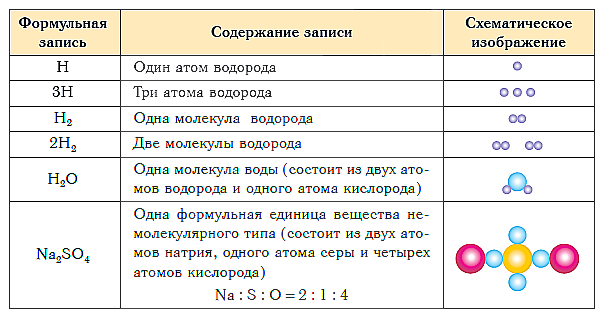
В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
Краткие выводы урока:
- Качественный и количественный состав вещества выражается с помощью химических формул.
- Химическая формула вещества молекулярного строения показывает состав его молекулы, которая является элементарной структурной единицей данного вещества.
- Химическая формула вещества немолекулярного строения показывает простейшее соотношение атомов в его формульной единице.
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
8 класс
Что нужно знать к промежуточной аттестации по химии
- Основные химические понятия.
- Свойства кислорода, водорода и воды.
- Систематизацию химических элементов.
- Строение атома.
- Химические связи.
- Теорию растворимости.
- Серу и её соединения.
- Технику безопасности обращения с химической посудой и оборудованием.
Способы подготовки к аттестации в 8 классе
Химию невозможно учить без опытов
В восьмом классе важно понять основы химических процессов. Но делать опыты самостоятельно в домашних условиях небезопасно
На Youtube-канале «Простая наука» можно посмотреть красочные химические опыты. Каждое действие подробно объясняется — просто смотрите и запоминайте.
Эффективно выучить Периодическую систему Д.И. Менделеева можно при помощи приложения «Викторина по химии». В нём 29 уровней сложности, на которых нужно на скорость определить группу элемента, атомный номер и другие параметры. Отличная тренировка при подготовке к аттестации по химии.
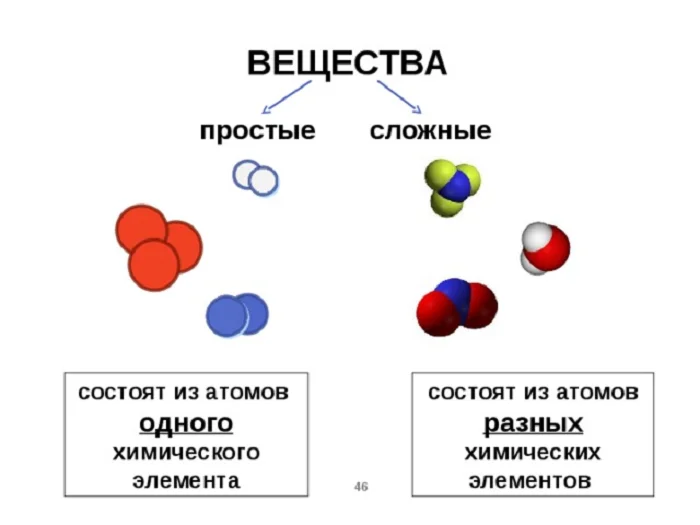
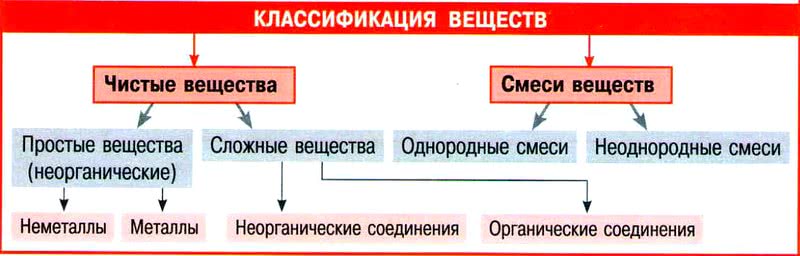
Вещество. Классификация веществ
От активности химических элементов зависит — будут они существовать в свободном виде или будут частью вещества.
Вещество – это совокупность атомов, атомных частиц или молекул, находящаяся в определённом агрегатном состоянии.
Вещества делятся: простые и сложные.
Определение достаточно несложное и легко запоминается.
Закономерно возникает вопрос: чем сложное вещество отличается от смеси простых и сложных веществ?
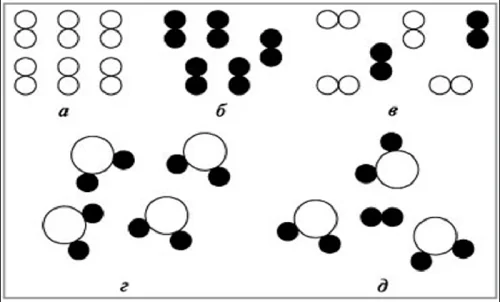
На рисунке обозначено:
А) молекулы простого вещества кислород О2;
Б) молекулы простого вещества водород Н2;
В) смесь простых веществ О2 и Н2;
Г) молекула сложного вещества вода Н2О;
Д) смесь молекул простого вещества водород Н2 и сложного вещества Н2О.
Смеси образуются в результате физического воздействия, например, смешивание железных опилок и воды, а сложные вещества – с помощью химического воздействия, например, ржавчина на железе, вызванная взаимодействием железа и воды.
В зависимости от того, какими частицами образованы вещества, их различают молекулярного и немолекулярного строения.
«Химия 8 класс. Все формулы и определения»
Ключевые слова: Химия 8 класс. Все формулы и определения, условные обозначения физических величин, единицы измерения, приставки для обозначения единиц измерения, соотношения между единицами, химические формулы, основные определения, кратко, таблицы, схемы.
| Физическая величина | Обозначение | Единица измерения |
| Время | t | с |
| Давление | p | Па, кПа |
| Количество вещества | ν | моль |
| Масса вещества | m | кг, г |
| Массовая доля | ω | Безразмерная |
| Молярная масса | М | кг/моль, г/моль |
| Молярный объем | Vn | м3/моль, л/моль |
| Объем вещества | V | м3, л |
| Объемная доля | Безразмерная | |
| Относительная атомная масса | Ar | Безразмерная |
| Относительная молекулярная масса | Mr | Безразмерная |
| Относительная плотность газа А по газу Б | DБ(А) | Безразмерная |
| Плотность вещества | р | кг/м3, г/см3, г/мл |
| Постоянная Авогадро | NA | 1/моль |
| Температура абсолютная | Т | К (Кельвин) |
| Температура по шкале Цельсия | t | °С (градус Цельсия) |
| Тепловой эффект химической реакции | Q |
кДж/моль |
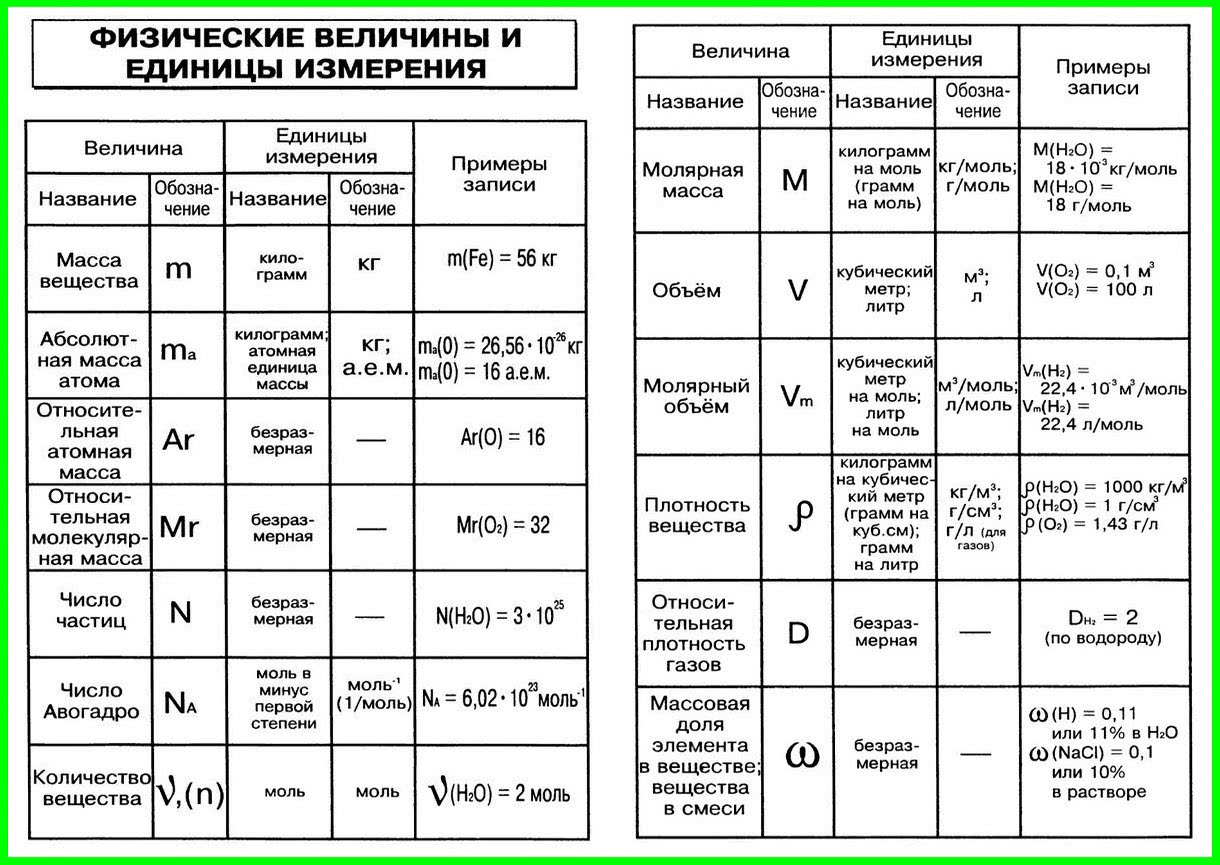
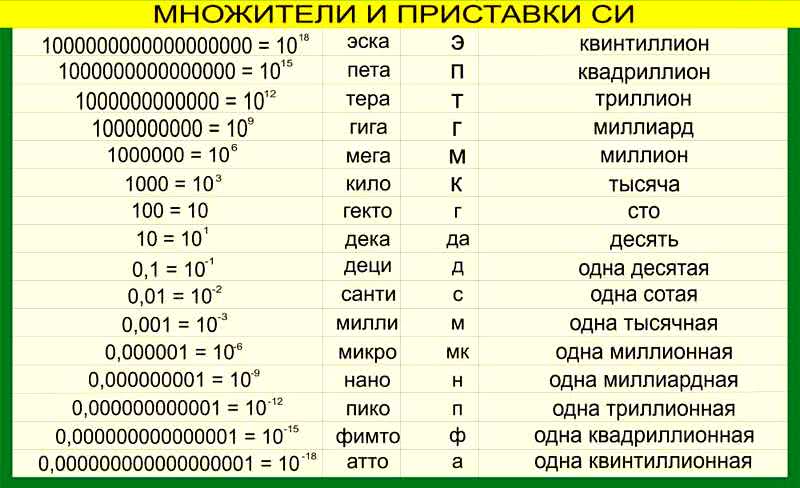
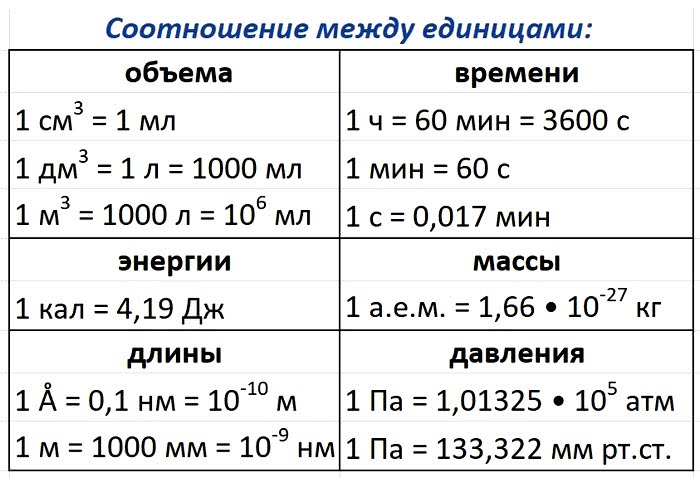
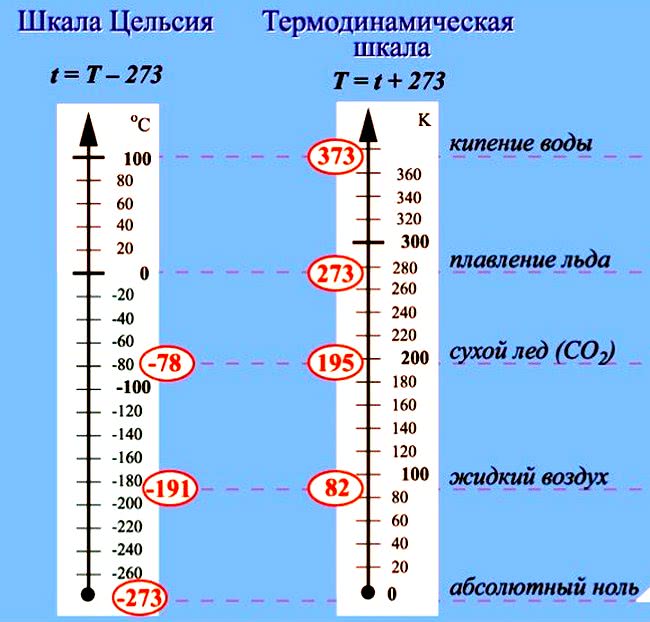
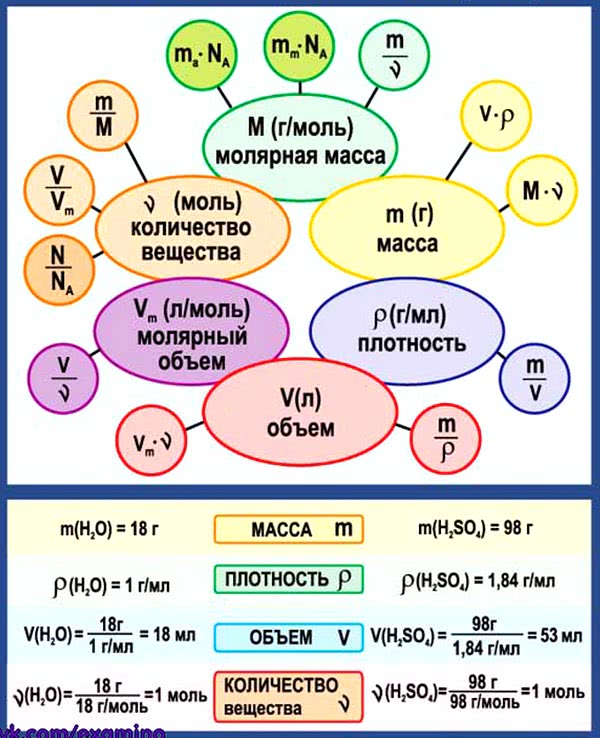
Схема. Химические формулы в 8 классе
4. Основные определения в 8 классе
- Атом — мельчайшая химически неделимая частица вещества.
- Химический элемент — определённый вид атомов.
- Молекула — мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов.
- Простые вещества — вещества, молекулы которых состоят из атомов одного вида.
- Сложные вещества — вещества, молекулы которых состоят из атомов разного вида.
- Качественный состав вещества показывает, из атомов каких элементов оно состоит.
- Количественный состав вещества показывает число атомов каждого элемента в его составе.
- Химическая формула — условная запись качественного и количественного состава вещества посредством химических символов и индексов.
- Атомная единица массы (а.е.м.) — единица измерения массы атома, равная массы 1/12 атома углерода 12С.
- Моль — количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг углерода 12С.
- Постоянная Авогадро (Na = 6*1023 моль-1) — число частиц, содержащихся в одном моле.
- Молярная масса вещества (М) — масса вещества, взятого в количестве 1 моль.
- Относительная атомная масса элемента Аr — отношение массы атома данного элемента m к 1/12 массы атома углерода 12С.
- Относительная молекулярная масса вещества Мr — отношение массы молекулы данного вещества к 1/12 массы атома углерода 12С. Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента.
- Массовая доля химического элемента ω(Х) показывает, какая часть относительной молекулярной массы вещества X приходится на данный элемент.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.

ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.Признаки химических реакций:
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
Химическое уравнение — запись химической реакции с помощью химических формул. Показывает, какие вещества и в каком количестве вступают в реакцию и получаются в результате реакции.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
Какой учебник по химии лучше
На основе сравнения достоинств, недостатков, актуальности информации, наличия гдз команда ВыборЭксперта.ру выбрала 4 издания для подготовки к экзаменам и углубления знаний по химии:
- Для изучения азов подойдёт учебник 8 класса Габриелян.
- Начала органики кратко и интересно описаны в учебнике 9 класса Рудзитис.
- Если нужен профильный учебник химии, рекомендуем материалы Ерёмина за 11 класс.
- Вдогонку к учебнику возьмите углублённый справочник Ерёмина для отработки и повторения теории.
Основываясь на критериях выбора, наших рекомендациях, составьте личный список литературы. Указанных книг достаточно для освоения общей, неорганической и органической химии на профильном уровне.
Другие грядущие изменения
Шахматы в начальной школе
Увеличится количество школ, в которых занятия шахматами станут обязательными для начальных классов по новому стандарту образования. Они заменят третий урок физкультуры. Для первоклассников нагрузка составит 33 часа в год, для остальных учеников — 34 часа. Учителя проходят дополнительную подготовку.
Второй иностранный язык
Помимо шахмат, обязательным предметом во многих школах станет второй иностранный — он вводится в рамках реализации новых ФГОС. Сейчас школы решают эту задачу поэтапно. За один день повсеместно ввести второй иностранный не получится.
ЕГЭ по иностранному языку
В 2020 иностранный язык не будет обязателен для сдачи на ЕГЭ, но по новому стандарту образования его планируется включить в перечень обязательных предметов с 2022 года. Экзамен будет разделён на два уровня: базовый и профильный. Возможно, в 2021 году будет проведена первая массовая апробация. Скорее всего, обязательным иностранным станет английский — язык международного общения.
ЕГЭ по истории
Вопреки опасениям школьников и родителей, обязательного ЕГЭ по истории в 2020 году не будет. Более того, нет ни одного документа или стандарта нового поколения, предполагающего включение этого предмета в число обязательных и в более отдалённой перспективе. Подобное изменение в части любого предмета потребует несколько лет для разработки и обсуждения экзаменационной модели для обязательного экзамена, её апробации и доработки. Такая работа не ведётся в настоящее время ни по одному из предметов, кроме иностранного языка.
Модернизация
В школах 50 регионов России в следующем году планируют открыть более 2000 классов с современной техникой: 3D-принтерами, интерактивными панелями, конструкторами по робототехнике и VR-очками. Планируется, что к 2024 году таких центров в российских школах будет 16 тысяч.





